
【题目】碘及其化合物可广泛用于医药和工业生产等。
(1)实验室用海带提取I2时操作步骤依次为:灼烧、溶解、过滤、__、__及蒸馏。
(2)灼烧海带时除需要三脚架、酒精灯、玻璃棒外,还需要的实验仪器是__。
(3)“过滤”后溶液中含一定量硫酸盐和碳酸盐。现要检验溶液中的I﹣,需选择的试剂组合及其先后顺序是__(选填编号)。
a.AgNO3溶液 b.Ba(NO3)2溶液 c.BaCl2溶液 d.CaCl2溶液
(4)在海带灰滤液中加入适量氯水后一定存在I2,可能存在IO3﹣。请补充完整检验含I2溶液中是否含有IO3﹣的实验方案(可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液):
①取适量含I2溶液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;
②__。
(5)分解水可用SO2/I2循环法。该法共涉及三步化学反应。__;2H2SO4![]() 2SO2↑+O2↑+2H2O;__。与传统的分解水的方法相比,本法的优点是__;缺点是__。
2SO2↑+O2↑+2H2O;__。与传统的分解水的方法相比,本法的优点是__;缺点是__。
【答案】氧化 萃取(或萃取分液) 坩埚(或瓷坩埚)、泥三角 ba 从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明滤液中含有IO3﹣,若溶液不变蓝,说明滤液中不含有IO3﹣ SO2+I2+2H2O=2HI+H2SO4 2HI![]() H2+I2 节约电能 使用能造成污染环境的SO2
H2+I2 节约电能 使用能造成污染环境的SO2
【解析】
(1)将海带灼烧、溶解、过滤后所得溶液中碘以I-存在,要将碘从水溶液中分离出来,应将I- 转化成水溶性差而易溶于有机溶剂的I2;
(2)根据灼烧装置即可找除出题中所列外还需要的实验仪器;
(3)检验I- 通常用AgNO3溶液,而Ag2SO4微溶、Ag2CO3难溶,所以SO42-和CO32-会干扰I-的检验,需排除干扰;
(4)检验IO3-可采用思路为:IO3- →I2 →检验I2,所以应选用合适的还原剂将IO3- 还原为I2,再检验生成的I2;
(5)根据题意,分解水采用的是SO2/I2循环法,可判断SO2和I2在整个过程中参与反应且能重新生成,由此判断各步反应;该法与电解水相比,不耗电但使用了能产生污染的SO2。
(1)根据分析,需把溶液中的I-转化为水溶性差而易溶于有机溶剂的I2,I- →I2为氧化过程;从水溶液中分离出I2可用CCl4等有机溶剂萃取后蒸馏。答案为:氧化;萃取(或萃取分液);
(2)固体灼烧需要坩埚,而坩埚需放在泥三角上加热,所以,灼烧海带时除需要三脚架、酒精灯、玻璃棒外,还需要的实验仪器是坩埚(或瓷坩埚)、泥三角。答案为:坩埚(或瓷坩埚)、泥三角;
(3)由于碘化银是不溶于水,也不溶于酸的黄色沉淀,所以可用AgNO3溶液检验。但Ag2SO4微溶、Ag2CO3难溶,所以SO42-和CO32-会干扰I- 的检验,所以需要排除其干扰,又因为还不能引入氯离子,所以可以用足量的Ba(NO3)2溶液除去SO42-和CO32-,过滤后(或取上层清液)再加入AgNO3溶液。答案为:ba;
(4)碘酸根具有强氧化性,能被还原为单质碘,而碘遇淀粉显蓝色,所以检验碘酸根的实验操作是:从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明滤液中含有IO3-;若溶液不变蓝,说明滤液中不含有IO3-;
⑸依题意,用SO2/I2循环法分解水共涉及三步化学反应。根据第二个反应可知,首先SO2被氧化为硫酸,氧化剂为I2,化学方程式为:SO2+ I2+ 2H2O = 2HI + H2SO4;生成的HI分解即可得到氢气,同时重新生成I2,所以第三个化学方程式为:2HI![]() H2+ I2。电解水需要消耗电能,而SO2又是大气污染物,所以与传统的分解水的方法相比,本法的优点是节约电能,而缺点是使用能造成污染环境的SO2。
H2+ I2。电解水需要消耗电能,而SO2又是大气污染物,所以与传统的分解水的方法相比,本法的优点是节约电能,而缺点是使用能造成污染环境的SO2。


科目:高中化学 来源: 题型:
【题目】(1)化合物![]() 的相对分子质量为86,所含碳的质量分数为
的相对分子质量为86,所含碳的质量分数为![]() ,氢的质量分数为
,氢的质量分数为![]() ,其余为氧。
,其余为氧。
①![]() 的分子式为______。
的分子式为______。
②![]() 有多种同分异构体,写出五个同时满足下列条件的同分异构体的结构简式:______、______、______、______、______。
有多种同分异构体,写出五个同时满足下列条件的同分异构体的结构简式:______、______、______、______、______。
(i)含有酯基(ii)能使溴的四氯化碳溶液褪色
(2)烃基烯基醚(![]() )
)![]() 的相对分子质量为176,其分子中碳氢原子个数比为
的相对分子质量为176,其分子中碳氢原子个数比为![]() ,则
,则![]() 的分子式为______。
的分子式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中除铁时还常用NaClO3作氧化剂,在较小的pH条件下最终生成一种浅黄色的黄铁矾钠 [Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域。下列说法不正确的是 {已知25℃,Ksp[Fe(OH)3]=2.64×10-39}
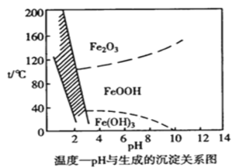
A.工业生产黄铁矾钠,温度控制在85~95℃pH=1.5左右
B.pH=6,温度从80℃升高至150℃体系得到的沉淀被氧化
C.用氯酸钠在酸性条件下氧化Fe2+ 离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
D.在25℃时溶液经氧化,调节溶液pH=4 ,此时溶液中c(Fe3+)=2.64×10-9 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X与Y可形成化合物![]() ,Z元素可形成负一价离子。下列说法正确的是( )
,Z元素可形成负一价离子。下列说法正确的是( )
A.X元素原子的基态电子排布式为![]()
B.X元素是第四周期第ⅤA族元素
C.Y元素原子的电子排布图为![]()
D.Z元素的单质![]() 在氧气中不能燃烧
在氧气中不能燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2NO2(g)![]() N2O4(g) + 57 kJ,若保持气体总质量不变。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
N2O4(g) + 57 kJ,若保持气体总质量不变。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
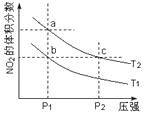
A.a、c两点气体的颜色:a浅,c深
B.a、c两点气体的平均相对分子质量:a>c
C.b、c两点的平衡常数:Kb=Kc
D.状态a通过升高温度可变成状态b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,草酸(H2C2O4)的Ka1=5.4×10-2,Ka2=5.4×10-5,是一种常用的除锈剂。0.1mol/L的NaHC2O4溶液中,下列粒子的物质的量浓度关系不正确的是( )
A.c(Na+)>c(HC2O4-)>c(OH-)>c(H2C2O4)>c(H+)
B.c(Na+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4)
C.c(Na+)+c(H+)= c(HC2O4-)+2c(C2O42-)+c(OH-)
D.c(H+)+c(H2C2O4)= c(OH-)+c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘酸钾作为食盐—碘添加剂,而碘化钾则是化工生产中一种重要原料。还原法生产碘化钾是由碘与氢氧化钾反应生成碘酸钾后,用甲酸还原而得,其主要流程如图。
请回答下列问题:
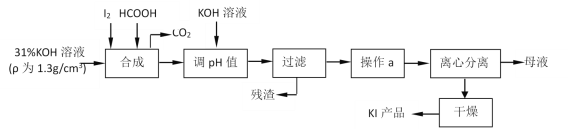
(1)判断“合成”过程中,碘是否已完全反应的方法是___。
(2)实验室中,过滤操作要求“一贴二低三靠”,其中“三靠”是指盛有被过滤液体的烧杯注液口紧靠玻璃棒、___、___。
操作a包括“蒸发浓缩、冷却结晶”是依据KI具有何种性质:___。
(3)写出“合成”过程中,HCOOH参与的离子反应方程式:___。
(4)测定产品中KI含量的方法是:
a.称取3.340g样品、溶解,在250mL容量瓶中定容;
b.量取25.00mL溶液于锥形瓶中,加入足量KIO3,用少量稀硫酸酸化所,使KIO3与KI反应完全;
c.以淀粉为指示剂,用0.2400mol/L的Na2S2O3溶液滴定,消耗溶液体积平均值为10.00mL。
已知:IO3-+I-+H+→I2+H2O(未配平),I2+2S2O32-→2I-+S4O62-。
①测定过程所需仪器在使用前必须检查是否漏液的有___。
②该样品中KI的质量分数为___。(保留3位有效数字)
(5)有学生选用家庭厨房中的有关调料(如黄酒、白醋、酱油、味精等),用简便方法来检测是否是加碘食盐。通过实践,发现厂商只要在食盐包装的封口处夹一条碘化钾淀粉试纸,并在袋上注明使用方法就能鉴别真伪。现请你写出检测使用说明书___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将有机物完全燃烧,生成CO2和H2O,将12 g该有机物完全燃烧产物通过浓硫酸,浓硫酸增重14.4 g,再通过碱石灰,又增重26.4 g。则该有机物的分子式为( )
A. C4H10 B. C2H6O
C. C3H8O D. C2H4O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁(![]() )是一种用途广泛的化工原料,工业上常用废铁屑和稀硫酸制备。
)是一种用途广泛的化工原料,工业上常用废铁屑和稀硫酸制备。
实验室通过图7装置模拟其制备过程。请回答下列问题:
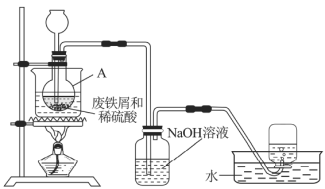
(1)进行实验之前需检查整套装置的______。装置甲中仪器A的名称是______,铁和稀硫酸反应后所得溶液呈______色。
(2)常温下废铁屑和稀硫酸反应较慢,而直接加热时温度过高又可能产生![]() 等副产物,因此,采用水浴加热,并使用过量的
等副产物,因此,采用水浴加热,并使用过量的![]() 将可能产生的
将可能产生的![]() 还原成
还原成![]() 。
。![]() 还原
还原![]() 的离子方程式为______________。
的离子方程式为______________。
(3)为验证反应后A中溶液是否含![]() ,取A中少量溶液快速冷却后,迅速滴入几滴
,取A中少量溶液快速冷却后,迅速滴入几滴![]() 溶液,溶液颜色无明显变化,说明A中溶液__________(填“含有”或“不含”)
溶液,溶液颜色无明显变化,说明A中溶液__________(填“含有”或“不含”)![]() 。
。
(4)废铁屑中含有硫化物杂质,故反应中会生成少量的![]() 气体。因此,装置乙中
气体。因此,装置乙中![]() 溶液的主要作用是______,装置丙中集气瓶收集到的气体主要是________。
溶液的主要作用是______,装置丙中集气瓶收集到的气体主要是________。
(5)将![]() 废铁屑(
废铁屑(![]() 单质的质量分数为80%,杂质为
单质的质量分数为80%,杂质为![]() 和
和![]() )与
)与![]() 的
的![]() 溶液充分反应,
溶液充分反应,![]() 的理论产量为____
的理论产量为____![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com