
下列化工生产过程中所发生的反应不属于氧化还原反应的是
A.用氯气和消石灰制漂白粉
B.用氢气和氮气合成氨
C.用铁矿石炼铁
D.用石灰石生产生石灰
科目:高中化学 来源: 题型:
某气态烃0.5 mol能与1 mol HCl完全加成,加成后产物分子上的氢原子又可被3 mol Cl2完全取代,则此气态烃可能是
( )
A.HC≡CH B.CH2===CH2
C.CH3—C≡CH D.
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则该溶液中( )
A.一定有S B.可能有S
B.可能有S 或Ag+
或Ag+
C.一定无Ag+ D.还可能有C
查看答案和解析>>
科目:高中化学 来源: 题型:
化学实验中有时需要将某些溶液或试剂进行酸化,下列酸化方法正确的是
A.检验C2H5Cl中的氯元素:先将C2H5Cl与NaOH溶液混合后加热,再加盐酸酸化
B.提高KMnO4溶液的氧化能力:用盐酸将KMnO4溶液酸化
C.鉴定溶液中是否有Fe2+:先将溶液用硝酸酸化,再加入KSCN溶液
D.检验溶液中是否有SO42-:先将溶液用足量的盐酸酸化,再加入BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是____________,烧杯间填满碎塑料泡沫的作用是_________________________。
(2) 大烧杯上如不盖硬纸板,则求得的中和热数值_______(填“偏大”、“偏小’、“无影响”)
(3) 实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所求中和热的数值会________(填“相等”或“不相等”),理由是______________________。
(4)设50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液反应的反应热为△H1,25mL0.5mol/L的浓硫酸与50mL0.55mol/L的NaOH溶液反应的反应热为△H2, 50mL0.5mol/L的醋酸与50mL0.55mol/L的NaOH溶液反应的反应热为△H3,则△H1、△H2、△H3的关系是 。(用“>”“<”或“=”连接)
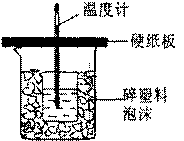
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.标准状况下11.2 L N2和17 g NH3中所含有的N原子数相同
B.9 g H2O和0.5 mol O2中含的原子数相同
C.20℃时,相同体积的N2、 O2一定含有相同的分子数
D.在常温常压下20 mL CH4与60 mL O2所含的原子个数比为1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O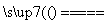 6Cu+SO2↑,下列说法中错误的是
6Cu+SO2↑,下列说法中错误的是
A.在Cu2O、Cu2S中Cu元素化合价都是+1价
B. 反应中Cu元素被氧化,S元素被还原
C. Cu2S在反应中既是氧化剂,又是还原剂
D.每生成6.4gCu,反应中转移0.1 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了下图所示装置进行有关实验:
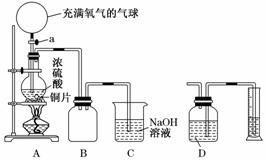
(1)先关闭活塞a,将6.4 g铜片和10 mL 18 mol/L的浓硫酸放在圆底烧瓶中共热至反应完成,发现烧瓶中还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中圆底烧瓶内发生反应的化学方程式:
打开活塞a之前___________________________________________________;
打开活塞a之后___________________________________________________。
②B是用来收集实验中产生的气体的装置,但集气瓶内的导管未画全,请直接在图上把导管补充完整。
(2)实际上,在打开活塞a之前硫酸仍有剩余。为定量测定余酸的物质的量,甲、乙两学生进行了如下设计:
①甲学生设计的方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定余酸的物质的量。他测定SO2的方法是将装置A产生的气体缓缓通过装置D,从而测出装置A产生气体的体积(已折算成标准状况下)。你认为甲学生设计的实验方案中D装置中的试剂为______________________(填化学式)。
②乙学生设计的方案是:将反应后的溶液冷却后全部移入到烧杯中稀释,并按正确操作配制100 mL溶液,再取20 mL于锥形瓶中,用________作指示剂,用标准氢氧化钠溶液进行滴定[已知:Cu(OH)2开始沉淀的pH约为5],选择该指示剂的理由为__________________________________________________;再求出余酸的物质的量,若耗去a mol/L氢氧化钠溶液b mL,则原余酸的物质的量为________mol(用含a、b的表达式来表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com