

分析 铝土矿用盐酸溶解,Al2O3、Fe2O3反应得到AlCl3、FeCl3,SiO2不与盐酸反应,过滤得到固体a为SiO2,滤液中含有AlCl3、FeCl3及剩余的HCl,再加入过量的烧碱,反应得到氢氧化铁沉淀、偏铝酸钠、氯化钠,过滤,红褐色沉淀b为氢氧化铁,溶液中含有偏铝酸钠、氯化钠及剩余的NaOH,通入过量的二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠,过滤,滤液c中含有氯化钠、碳酸氢钠,将沉淀加热分解得到氧化铝,用硫酸溶解得到硫酸铝溶液,再通入氨气,得到铵明矾溶液,最后经过蒸发浓缩、冷却结晶、过滤等操作得到铵明矾晶体.
(3)根据Al2O3+3H2SO4=Al2(SO4)3+3H2O计算消耗溶质硫酸的质量,再计算需要硫酸溶液的质量,根据V=$\frac{m}{ρ}$计算硫酸溶液的体积;
(4)设制得的Al2(SO4)3和NH4Al(SO4)2•12H2O的物质的量都是1 mol,根据Al3+和SO42-守恒计算.
解答 解:铝土矿用盐酸溶解,Al2O3、Fe2O3反应得到AlCl3、FeCl3,SiO2不与盐酸反应,过滤得到固体a为SiO2,滤液中含有AlCl3、FeCl3及剩余的HCl,再加入过量的烧碱,反应得到氢氧化铁沉淀、偏铝酸钠、氯化钠,过滤,红褐色沉淀b为氢氧化铁,溶液中含有偏铝酸钠、氯化钠及剩余的NaOH,通入过量的二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠,过滤,滤液c中含有氯化钠、碳酸氢钠,将沉淀加热分解得到氧化铝,用硫酸溶解得到硫酸铝溶液,再通入氨气,得到铵明矾溶液,最后经过蒸发浓缩、冷却结晶、过滤等操作得到铵明矾晶体.
(1)由上述分析可知,固体a的化学式为SiO2,故答案为:SiO2;
(2)由图中Ⅴ制取铵明矾溶液的化学方程式为:Al2O3+4H2SO4+2NH3═2NH4Al(SO4)2+3H2O,从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、过滤洗涤,
故答案为:Al2O3+4H2SO4+2NH3═2NH4Al(SO4)2+3H2O;蒸发浓缩;
(3)m(Al2O3)=1 000 kg×36%=360 Kg,
Al2O3+3H2SO4=Al2(SO4)3+3H2O
102 294
360Kg m(H2SO4)
故m(H2SO4)=$\frac{294×360Kg}{102}$=1037.6 Kg,
需消耗质量分数98%的硫酸(密度1.84 g•cm-3)为=$\frac{1037.6Kg÷98%}{18400kg/L}$=575.4 L,
故答案为:575.4;
(4)设制得的Al2(SO4)3和NH4Al(SO4)2•12H2O的物质的量都是1 mol,则Al3+共3 mol,SO42-共5 mol,根据Al3+和SO42-守恒可得,加入Al2O3和H2SO4的物质的量之比为$\frac{3}{2}$:5=3:10,故答案为:3:10.
点评 本题考查化学工艺流程、物质的分离提纯、化学计算等,需要学生具备综合运用知识分析问题解决问题能力,难度中等.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B2)=0.8 mol/(L•s) | B. | v(A2)=0.4 mol/(L•s) | C. | v(C)=0.6 mol/(L•s) | D. | v(B2)=1.0 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | |||||||
| B | C | D | |||||
| E | F | G | |||||
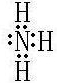 .
.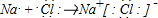 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在三种元素中,元素Z的非金属性最强 | |
| B. | 气态氢化物的还原性按X、Y、Z的顺序逐渐增强 | |
| C. | Y元素一定是硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
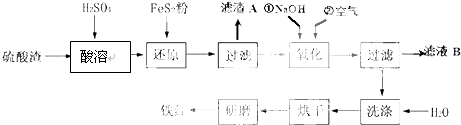
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com