
【题目】氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯.目前Cl2O、ClO2、Cl2O7已能制取.有关数据见下表:
化学式 | Cl2O | ClO2 | Cl2O7 |
相对分子质量 | 87 | 67.5 | 183 |
沸点/℃ | 2 | 9.7 | 81 |
完成下列填空:
(1)Cl2O是酸的酸酐,Cl2O电子式为 .
(2)下列能判断Cl和O两种元素非金属性强弱的是(选填编号).
a.氧化氯的分子式 b.与金属反应得电子的数目
c.气态氢化物的稳定性 d.最高价氧化物对应水化物的酸性
(3)根据分子间作用力对沸点影响的变化规律:组成和结构相似的分子,其沸点随着相对分子质量的增大而升高,但上表中相对分子质量是Cl2O7>Cl2O>ClO2 , 其沸点的变化不是Cl2O7>Cl2O>ClO2的原因是
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2﹣)和氯酸盐,其离子方程式是 , 氧化产物 . (填离子符号)
(5)一定条件下,在水溶液中1mol Cl﹣、ClO ![]() (x=1,2,3,4)的能量(kJ)相对大小如图所示.D是(填离子符号).B→A+C的热化学方程式为(用离子符号表示).
(x=1,2,3,4)的能量(kJ)相对大小如图所示.D是(填离子符号).B→A+C的热化学方程式为(用离子符号表示). 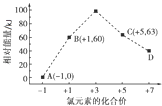
【答案】
(1)HClO;![]()
(2)ac
(3)Cl2O7、Cl2O、ClO2结构不相似,不符合分子间作用力对沸点影响的变化规律
(4)2ClO2+2OH﹣=ClO2﹣+ClO3﹣+H2O;ClO3﹣
(5)ClO4﹣;3ClO﹣(aq)=ClO3﹣(aq)+2Cl﹣(aq)△H=﹣117kJ/mol
【解析】解:(1)酸酐与对应酸中Cl元素的化合价相同,则Cl2O是为HClO的酸酐,Cl2O的结构为Cl﹣O﹣Cl,其电子式为 ![]() ,所以答案是:HClO;
,所以答案是:HClO; ![]() ;(2)a.氧化氯的分子式中O为负价,则非金属性O大于Cl,故正确; b.与金属反应得电子的数目,不能比较非金属性,故错误;c.气态氢化物的稳定性强的为水,则非金属性O大于Cl,故正确d.O元素不存在最高价氧化物对应水化物,故错误;所以答案是:ac;(3)上表中相对分子质量是Cl2O7>Cl2O>ClO2 , 其沸点的变化不是Cl2O7>Cl2O>ClO2的原因是Cl2O7、Cl2O、ClO2结构不相似,不符合分子间作用力对沸点影响的变化规律,所以答案是:Cl2O7、Cl2O、ClO2结构不相似,不符合分子间作用力对沸点影响的变化规律;(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2﹣)和氯酸盐,为氧化还原反应,离子反应为2ClO2+2OH﹣=ClO2﹣+ClO3﹣+H2O,Cl元素失去电子被氧化,则氧化产物为ClO3﹣ , 所以答案是:2ClO2+2OH﹣=ClO2﹣+ClO3﹣+H2O;ClO3﹣;(5)由图可知,D中Cl元素的化合价为+7价,则D为ClO4﹣;B→A+C结合转移电子守恒得该反应方程式为3ClO﹣=ClO3﹣+2Cl﹣ , △H=(63kJ/mol+2×0kJ/mol)﹣3×60kJ/mol=﹣117kJ/mol,所以该热化学反应方程式为3ClO﹣(aq)=ClO3﹣(aq)+2Cl﹣(aq)△H=﹣117kJ/mol,所以答案是:ClO4﹣;3ClO﹣(aq)=ClO3﹣(aq)+2Cl﹣(aq)△H=﹣117kJ/mol.
;(2)a.氧化氯的分子式中O为负价,则非金属性O大于Cl,故正确; b.与金属反应得电子的数目,不能比较非金属性,故错误;c.气态氢化物的稳定性强的为水,则非金属性O大于Cl,故正确d.O元素不存在最高价氧化物对应水化物,故错误;所以答案是:ac;(3)上表中相对分子质量是Cl2O7>Cl2O>ClO2 , 其沸点的变化不是Cl2O7>Cl2O>ClO2的原因是Cl2O7、Cl2O、ClO2结构不相似,不符合分子间作用力对沸点影响的变化规律,所以答案是:Cl2O7、Cl2O、ClO2结构不相似,不符合分子间作用力对沸点影响的变化规律;(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2﹣)和氯酸盐,为氧化还原反应,离子反应为2ClO2+2OH﹣=ClO2﹣+ClO3﹣+H2O,Cl元素失去电子被氧化,则氧化产物为ClO3﹣ , 所以答案是:2ClO2+2OH﹣=ClO2﹣+ClO3﹣+H2O;ClO3﹣;(5)由图可知,D中Cl元素的化合价为+7价,则D为ClO4﹣;B→A+C结合转移电子守恒得该反应方程式为3ClO﹣=ClO3﹣+2Cl﹣ , △H=(63kJ/mol+2×0kJ/mol)﹣3×60kJ/mol=﹣117kJ/mol,所以该热化学反应方程式为3ClO﹣(aq)=ClO3﹣(aq)+2Cl﹣(aq)△H=﹣117kJ/mol,所以答案是:ClO4﹣;3ClO﹣(aq)=ClO3﹣(aq)+2Cl﹣(aq)△H=﹣117kJ/mol.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )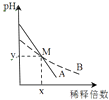
A.稀释前,c(A)>10 c(B)
B.中和等浓度等体积的盐酸时,B用的体积较多
C.M点时A和B的浓度相等
D.在M点,A,B两种碱溶液中阳离子的物质的量浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳是生命的核心元素”这种说法的依据是( )
A.蛋白质、核酸等生物大分子中都含有C、H、O三种元素
B.组成一些重要生物大分子的单体均以碳链为基本骨架
C.脂质、糖类及蛋白质等生物大分中的碳元素含量均最高
D.糖类是生物体内的主要能源物质,又称“碳水化合物”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项操作中,错误的是( )
A. 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液
B. 进行萃取操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C. 萃取分液前需对分液漏斗检漏
D. 为保证分液漏斗内的液体顺利流出,需将上面的塞子拿下
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业炼铁用一氧化碳还原氧化铁时会发生如下一系列反应:
3Fe2O3+CO→2Fe3O4+CO2
Fe3O4+CO→3FeO+CO2
FeO+CO→Fe+CO2
某次实验中,用CO还原4.80g氧化铁,当固体质量变成4.56g时,测得此固体中只存在2种氧化物.则此固体成分和它们的物质的量之比可能的是( )
A.n(FeO):n(Fe3O4)=1:1
B.n(Fe2O3):n(FeO)=2:1
C.n(Fe2O3):n(FeO)=1:2
D.n(Fe2O3):n(Fe3O4)=1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用饱和FeCl3溶液制取Fe(OH)3胶体,正确的操作是( )
A.将FeCl3溶液滴入蒸馏水中即可
B.将FeCl3溶液滴入热水中,生成棕黄色液体即可
C.将FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色液体即可
D.将FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色沉淀即可
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 硫酸钡不溶于水,所以硫酸钡是非电解质
B. 铜可以导电,所以铜是电解质
C. 氯化钠溶液能导电,所以氯化钠溶液是电解质
D. 液态氯化氢不能导电,但氯化氢是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的描述或操作错误的是( )
A.提取海带中碘元素,为保证I-完全氧化为I2 , 加入的氧化剂(H2O2或新制氯水)均应过量
B.纸上层析法通常以滤纸作为惰性支持物。滤纸纤维上的羟基具有亲水性,它所吸附的水作为固定相
C.制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干
D.减压过滤不宜用于过滤胶状沉淀或颗粒太小的沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合溶液中,各离子浓度的大小顺序正确的是( )
A.10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:c(Cl﹣>c(NH ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
B.10 mL 0.1 mol/L NH4Cl溶液与5mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(Cl﹣)>c(OH﹣)>c(H+)
C.10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(CH3COO﹣)>c(OH﹣)>c(H+)
D.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl﹣)>c(Na+)>c(OH﹣)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com