
【题目】在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+ O2 (g)![]() 2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)降低温度,该反应K值______,二氧化硫转化率____,化学反应速度____ ,(以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是_____。

(3)据图判断,反应进行至20min时,曲线发生变化的原因_____(用文字表达)
(4)10min到15min的曲线变化的原因可能是____(填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
【答案】增大 增大 减小 15-20min、25-30min 增大氧气的浓度 ab
【解析】
(1)降温,放热反应平衡正移,K增大,反应物转化率增大,速率减小;
(2)各组分的物质的量不变,反应处于平衡状态;
(3)找断点,瞬间只有氧气的浓度增大,应是增大了氧气的浓度;
(4)10min到15min的曲线斜率变大,反应方向不变,且没有出现断点。
(1)该反应正反应为放热反应,降低温度平衡向正反应方向移动,平衡常数K增大,二氧化硫转化率增大,降低温度反应速率减小;
(2)反应混合物各物质的物质的量不变化,说明反应处于平衡状态,由图可知在15-20min和25-30min出现平台,各组分的物质的量不变,反应处于平衡状态;
(3)由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大,应是增大了氧气的浓度;
(4)由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大;且10min改变瞬间,各物质的物质的量不变。
a.加了催化剂,增大反应速率,故a正确;
b.缩小容器体积,增大压强,增大反应速率,故b正确;
c.降低温度反应速率降低,故c错误;
d.10min改变瞬间,各物质的物质的量不变,不是增加SO3的物质的量,故d错误;
答案选ab。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、Q、R的原子序数依次增大,X的简单阴离子与锂离子具有相同的电子层结构,Y原子最外层电子数等于内层电子数的2倍,Q的单质与稀硫酸剧烈反应生成X的单质。向100mL X2R的水溶液中缓缓通入RZ2气体,溶液pH与RZ2体积关系如图。下列说法错误的是
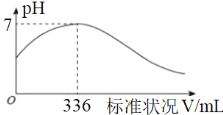
A.单质的沸点:Q>Z>XB.X2R溶液的浓度为0.3 molL-1
C.简单气态氢化物稳定性Z>R>YD.将RZ2分别通入BaCl2、Ba(NO3)2溶液中,均无明显现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.56 g Fe在足量Cl2中充分燃烧,转移电子数为2×6.02×1023
B.合成氨反应放热,采用低温可以提高氨的生成速率
C.常温下Na2CO3溶液中加入少量Ca(OH)2固体,溶液中![]() 的值减小
的值减小
D.若电工操作中将铝线与铜线直接相连会导致铜线更快被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A. 反应在t1 min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D. 温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作能使100mLc(H+)=1mol·L-1的盐酸变成c(HCl)=2mol·L-1的是( )
A.加热蒸发至50mL溶液
B.加入3mol·L-1盐酸100mL
C.加入4mol·L-1盐酸100mL后稀释至250mL
D.通入4.48L HCl气体并稀释到200mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
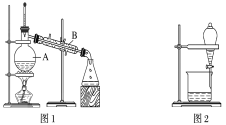
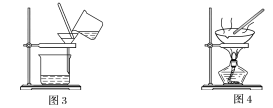
(1)装置图1中B的名称是________________,图2中漏斗的名称是________________。A中一般要加入碎瓷片,其作用是__________________________。下列关于以上实验操作说法一定正确的是_。
A.图1实验中,加热一段时间后发现未加入碎瓷片,应马上添加,以防发生危险
B.图2实验中,应打开活塞,将有机溶剂从下端导管中放出
C.图3实验中,可以用玻璃棒在漏斗中搅拌,以加快过滤速度
D.图4实验中,当加热至有较多固体析出时,即停止加热
(2)现有一瓶A和B的混合液,已知它们的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离可选用上图中的图________________所示仪器。
(3)在图2所示实验中,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下图所示装置来制备乙炔,并验证乙炔的某些化学性质,制备的 乙炔气体中往往含有少量的 H2S 和PH3气体,请按下列要求填空:

(1)实验室制乙炔的化学方程式是:_________________;为了得到较为平稳的乙炔气流, 装置 A 的分液漏斗中常用______________来代替水.
(2)装置 B 中CuSO4溶液的作用是_______________________________.
(3)装置 D 中观察到的现象是 ___________________________________________
(4)若称取m g 电石,反应完全后,生成的乙炔n g,则CaC2的纯度为_____(用m与n表示)。
(5)写出以乙炔和HCl为原料,合成聚氯乙烯的方程式是________________,___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示。A是石灰石加热分解的固体产物,B是一种能使品红溶液褪色的无色气体,D是一种常见的无色液体,F是某种补血剂的有效成分,G是一种常见的强酸,反应①是石灰石脱硫处理过程的反应之一。
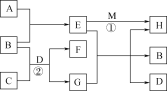
(1) A的化学式为________。
(2) D的电子式为________。
(3) 写出反应①的化学方程式:________________________。
(4) 写出反应②的离子方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2俗名称作光气,是有毒气体。在一定条件下,可发生的化学反应为:COCl2(g) ![]() CO(g)+Cl2(g) ΔH<0 下列有关说法不正确的是
CO(g)+Cl2(g) ΔH<0 下列有关说法不正确的是
A. 在一定条件下,使用催化剂能加快反应速率
B. 当反应达平衡时,恒温恒压条件下通入Ar,COCl2的转化率不变
C. 单位时间内生成CO和消耗Cl2的物质的量比为1∶1时,反应达到平衡状态
D. 平衡时,其他条件不变,升高温度可使该反应的平衡常数减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com