
【题目】标准状况下有①6.72 L CH4;②3.01×1023个HCl分子;③7.2 g H2O,下列对这三种物质的关系从小到大的排列顺序是:
(1)物质的量______;
(2)体积______;
(3)质量______;
(4)氢原子数______。
【答案】①<③<② ③<①<② ①<③<② ②<③<①
【解析】
(1)根据n=![]() 、n=
、n=![]() 、n=
、n=![]() 计算物质的量,然后比较大小;
计算物质的量,然后比较大小;
(2)气体物质体积大于液态物质的体积,对于气体,根据n=![]() 可知气体的物质的量越多,气体的体积越大比较;
可知气体的物质的量越多,气体的体积越大比较;
(3)先计算气体的物质的量,然后根据n=![]() 计算气体质量,然后比较大小;
计算气体质量,然后比较大小;
(4)先计算物质的量,然后利用n(H)=已知物质的物质的量与物质分子中含有的H原子数计算,最后根据n=![]() 可知:氢原子的物质的量越多,氢原子数目越多比较。
可知:氢原子的物质的量越多,氢原子数目越多比较。
(1)①6.72 L CH4的物质的量n(CH4)=![]() =0.3 mol;②3.01×1023个HCl分子的物质的量n(HCl)=
=0.3 mol;②3.01×1023个HCl分子的物质的量n(HCl)=![]() =0.5 mol;③7.2 g H2O的物质的量n(H2O)=
=0.5 mol;③7.2 g H2O的物质的量n(H2O)=![]() =0.4 mol,可见:物质的量从小到大的排列顺序是:①<③<②;
=0.4 mol,可见:物质的量从小到大的排列顺序是:①<③<②;
(2)在上述三种物质中,由于水在标准状态下是液、固混合物,不是气体,微粒间的间隔很小,其体积最小,对于CH4和HCl,都是气体,由n=![]() 可知:气体物质的量越多,气体体积越大,所以上述三种物质的体积从小到大的排列顺序是:③<①<②;
可知:气体物质的量越多,气体体积越大,所以上述三种物质的体积从小到大的排列顺序是:③<①<②;
(3)根据(1)计算可知①6.72 L CH4的物质的量为0.3 mol,则其质量m(CH4)=n·M=0.3 mol×16 g/mol=4.8 g;②3.01×1023个HCl分子的物质的量是0.5 mol,其质量为m(HCl)= n·M=0.5 mol×36.5g/mol=18.25 g;③H2O质量是7.2 g,则三种物质的质量从小到大的排列顺序是:①<③<②;
(4)①6.72 L CH4中H原子的物质的量n(H)=4n(CH4)=4×0.3 mol=1.2 mol;②3.01×1023个HCl分子中含有H原子的物质的量n(H)=n(HCl)=0.5 mol;③7.2 g H2O中含有H原子的物质的量n(H)=2n(H2O)=2×0.4 mol=0.8 mol。根据n=![]() 可知:原子的物质的量与其中含有的原子数目呈正比,所以三种物质所含H原子数从小到大的排列顺序是:②<③<①。
可知:原子的物质的量与其中含有的原子数目呈正比,所以三种物质所含H原子数从小到大的排列顺序是:②<③<①。


科目:高中化学 来源: 题型:
【题目】一定温度下,将3molA气体和1molB气体通入某密闭容器中,发生如下反应:![]() 。请回答下列问题:
。请回答下列问题:
(1)若容器体积固定为2L
①反应1min时测得剩余1.8mol A,C的浓度为0.4mol/L.1min内,B的平均反应速率为 ____________;x= ________
②若反应2min达到平衡,平衡时C的浓度 ______ (填“大于”“等于”或“小于”)0.8mol/L
③平衡混合物中,C的体积分数为22%,则A的转化率是 ______ ![]() 保留3位有效数字
保留3位有效数字![]()
(2)一定温度下,可逆反应:![]() 在体积固定的密闭容器中反应,达到平衡状态的标志是 ______
在体积固定的密闭容器中反应,达到平衡状态的标志是 ______
①单位时间内生成nmolO2,同时生成2nmolNO
②用NO、O2、NO2的物质的量浓度变化表示的反应速率的比:2:1:2
③混合气体的密度不随时间的变化而变化
④O2的物质的量浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国首艘使用了钛合金材料的国产航母已成功下水,钛(Ti)常温下与酸、碱均不反应,但高温下能被空气氧化,由钛铁矿(主要成分是FeO和TiO2)提取金属钛的主要工艺流程如图。下列说法错误的是( )
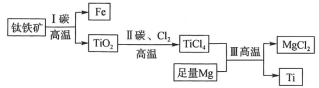
A.步骤Ⅰ中碳作还原剂
B.步骤Ⅱ中未发生氧化还原反应
C.步骤Ⅲ中需在氩气环境中进行,防止金属被空气氧化
D.可用稀硫酸除去金属钛中的少量镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁铝合金溶于 100 mL 稀硝酸中,产生 1.12 L NO气体(标准状况),向反应后的溶液中加入 NaOH 溶液,产生沉淀情况如图所示。下列说法不正确的是

A.可以求出合金中镁铝的物质的量比为 1∶1B.可以求出硝酸的物质的量浓度
C.可以求出沉淀的最大质量为 3.21 克D.氢氧化钠溶液浓度为 3 mol / L
查看答案和解析>>
科目:高中化学 来源: 题型:
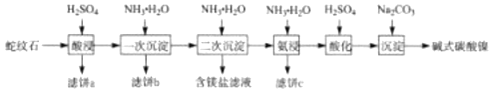
【题目】蛇纹石(含MgO、NiO、SiO2、Fe2O3、FeO等)因其外表青绿相问像蛇纹一样而得名。一种以蛇纹石为原料制取铁红和碱式碳酸镍[Ni3(OH)4CO34H2O]的流程如图:
已知:Ⅰ.该实验温度下,不同pH时铁沉淀物成分及热分解产物:
pH | 铁沉淀物成分 | 热分解产物 |
2.5 | NH4Fe3(SO4)2(OH)6 | Fe2O3,SO2,SO3,NH3,O2,H2O |
3.5 | α-FeOOH | Fe2O3,H2O |
Ⅱ.部分金属离子沉淀的pH:
Mg2+ | Fe2+ | Ni2+ | |
开始沉淀的pH | 9.4 | 6.5 | 6.7 |
沉淀完全的pH | 12.4 | 9.7 | 9.5 |
Ⅲ.“氨浸“后所得溶液中主要成分为[Ni(NH3)6]2+,且存在[Ni(NH3)6]2+ Ni2++6NH3请回答:
(1)滤饼a的主要成分为___。
(2)滤饼b经洗涤、煅烧可得铁红。则“一次沉淀”时应控制pH=__(填“2.5或“3.5”),其原因为___。
(3)“氨浸”时生成[Ni(NH3)6]2+的离子方程式为___;此过程会同时加入 NH4HCO3,其目的为___。
(4)“沉淀”前须先”酸化”,用平衡移动原理解释其原因为__。
(5)实验室测得Ni3(OH)4CO34H2O(M=377)样品在空气中受热时样品失重率(失重率=固体样品损失的总质量/起始加入样品的质量×100%)与温度(T)的关系如图所示。

①200oC时所得固体的化学式为___。
②250~350oC之间反应的化学方程式为___。
(6)碱式碳酸镍可进一步转化制得镍氢电池。镍氢电池的工作原理为:Ni(OH)2+M![]() NiOOH+MH(M表示储氢金属或合金)。该电池充电过程中阴极的电极反应式为___。
NiOOH+MH(M表示储氢金属或合金)。该电池充电过程中阴极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应mA(s) + nB(g) ![]() eC(g) + f D(g),当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
eC(g) + f D(g),当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
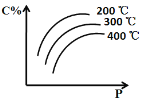
A. 化学方程式中n<e +f
B. 达到平衡后,若升温,v正减小,v逆增大
C. 达到平衡后,增加B的量,B的转化率增大
D. 若B为有色物质,达到平衡后缩小容器体积,重新达平衡后与原平衡比较气体颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向硝酸酸化的2mL0.1molL-1AgNO3溶液(pH=2)中加入过量铁粉,振荡后静置,溶液先呈浅绿色,后逐渐呈粽黄色,试管底部仍存有黑色固体,过程中无气体生成。实验小组同学针对该实验现象进行如下探究。
Ⅰ.探究Fe2+产生的原因
(1)提出猜想:Fe2+可能是Fe与____或___反应的产物。
(2)实验探究:在两支试管中分别加入与上述实验等量的铁粉,再加入不同的液体试剂,5min后取上层清液,分别加入相同体积和浓度的铁氰化钾溶液
液体试剂 | 加人铁氰化钾溶液 | |
1号试管 | 2mL.0.1molL-1AgNO3溶液 | 无蓝色沉淀 |
2号试管 | ______ | 蓝色沉淀 |
①2号试管中所用的试剂为____。
②资料显示:该温度下,0.1molL-1的AgNO3溶液可以将Fe氧化为Fe2+。但1号试管中未观察到蓝色沉淀的原因可能为____。
③小组同学继续进行实验,证明了2号试管得出的结论正确。实验如下:取100mL0.1molL-1硝酸酸化的AgNO3溶液(pH=2),加入铁粉井搅拌,分别插入pH传感器和NO3-传感器(传感器可检测离子浓度),得到如图图示,其中pH传感器测得的图示为___(填“图甲”或“图乙”)。
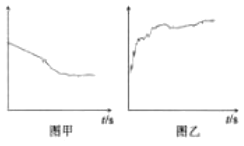
④实验测得2号试管中有NH4+生成,则2号试管中发生反应的离子方程式为___。
Ⅱ.探究Fe3+产生的原因
查阅资料可知,反应中溶液逐渐变棕黄色是因为Fe2+被Ag+氧化。小组同学设计不同实验方案对此进行验证。
(3)方案一;取出少量黑色固体,洗涤后___(填操作和现象),证明黑色固体中有Ag。
(4)方案二:按图连接装置,一段时间后取出左侧烧杯溶液,加人KSCN溶液,溶液变F红。该实验现象____(填“能“或“不能“)证明Fe2+可被Ag+氧化,理由为__。
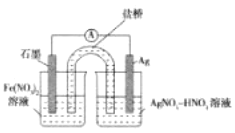
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通入乙烷(C2H6)和氧气,其中某一电极反应式为:C2H6+18OH--14e-=2CO![]() +12H2O。有关此电池的推断不正确的是( )
+12H2O。有关此电池的推断不正确的是( )
A.通入乙烷的电极为负极
B.放电一段时间后,KOH的物质的量浓度将下降
C.参加反应的O2与C2H6的质量比为32:105
D.溶液中的OH-向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O = SO42+4H++2Fe2+,Cr2O72+6Fe2++14H+ = 2Cr3++6Fe3++7H2O。下列说法正确的是( )
A.还原性:Cr3+>Fe2+>SO2B.氧化性:Cr2O72>Fe3+>SO2
C.Cr2O72不能将SO2氧化D.两个反应中Fe2(SO4)3均作还原剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com