
| A. | 只要是氧化还原反应原理都可以设计成原电池 | |
| B. | Cu+2H+═Cu2++H2↑在任何条件下都不能进行 | |
| C. | 金属的防护可以采取制成合金,改变内部结构的方法 | |
| D. | 现代潜艇的防腐是在潜艇底部贴锌板 |
分析 A.原电池的反应必须是自发的氧化还原反应;
B.电解池可以实现非自发的氧化还原反应的发生;
C.把金属制成合金可以防止金属被腐蚀;
D.现代潜艇是用特种钢材制成的.
解答 解:A.原电池的反应必须是自发的氧化还原反应,非自发的氧化还原反应不能构成原电池,如水的分解反应是氧化还原反应,但是不能设计为原电池,故A错误;
B.电解池可以实现反应Cu+H2SO4═CuSO4+H2↑的发生,金属铜作阳极,石墨作阴极,电解质采用硫酸溶液即可,故B错误;
C.把金属制成合金,改变了金属的内部结构,可以防止金属被腐蚀,故C正确;
D.现代潜艇是用特种钢材制成的,特种钢材具有抗腐蚀性,不是采用电化学方法来防腐,故D错误.
故选C.
点评 本题考查了原电池的原理、金属的腐蚀与防护,题目难度不大,根据原电池和电解池原理来分析解答即可,侧重于考查学生对基础知识的应用能力.


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:解答题
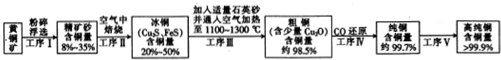
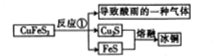
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 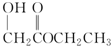 | B. | 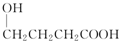 | C. | 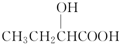 | D. | 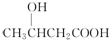 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一元素不可能既有金属性,又有非金属性 | |
| B. | 非金属元素组成的化合物中只含共价键 | |
| C. | 第三周期主族元素的最高化合价等于它所在的主族序数 | |
| D. | 短周期元素形成简单离子后,最外层电子都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氯元素的单质及其化合物在生产生活中都很重要.回答下列问题:
氯元素的单质及其化合物在生产生活中都很重要.回答下列问题: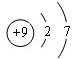 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
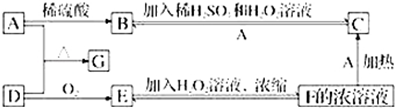
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| H的性质 | 推断H的组成和结构 |
| H完全燃烧的产物只有CO2和H2O | 组成:肯定含碳、氢两种元素,也可能含氧元素 |
| H与乙醇在一定条件下反应均能生成具有果香味的物质,且结构中只存在两种官能团 | 组成:含有O元素 |
| 1.34gH分别与足量的碳酸氢钠溶液和钠反应,生成标准状况下的气体体积分别为0.448L和0.336L | 组成:含有两个-COOH、一个-OH |
| H的碳链无支链 | 结构简式:HOOCCH(OH)CH2COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com