
【题目】四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍。元素M与Z同周期,且原子半径是同周期中最大的。元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙。
X | Y | |
Z | W |
请按要求回答下列问题:
(1)X的单质的电子式:_________;W最高价氧化物的水化物的化学式:________________。
(2)M、Z、W分别形成的简单离子的半径由大到小顺序为(填离子符号)__________;写一个能说明元素W比元素Z的非金属性强的化学方程式:____________________。
(3)甲变为乙的化学方程式为_______________________。
(4)常温下,当用200mL 1mol·L-1的MOH溶液吸收4.48L(已折算为标准状况)ZY2时,所得溶液的主要溶质(填化学式)为___________;此时溶液pH<7,则其中含Z元素的几种粒子(忽略ZY2)的浓度由大到小的顺序为___________________________。
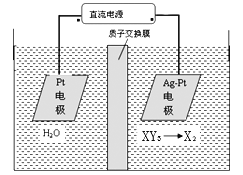
(5) 工业上用电化学法治理酸性废液中的XY3-的原理如图示,其阴极的反应式为_______________。
【答案】 ![]() HClO4 S2->Cl->Na+ H2S+Cl2=S2↓+HCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 NaHSO3 c(HSO3-)>c(SO32-)>c(H2SO3) 2NO3-+12H++10e-=N2↑+6H2O
HClO4 S2->Cl->Na+ H2S+Cl2=S2↓+HCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 NaHSO3 c(HSO3-)>c(SO32-)>c(H2SO3) 2NO3-+12H++10e-=N2↑+6H2O
【解析】Z原子最外层电子数是其电子层数的2倍,则Z为S元素;根据四种短周期元素在周期表中的相对位置,W为Cl元素,Y为O元素,X为N元素;元素M与Z同周期,且原子半径是同周期中最大的,M为Na元素。元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙,则R为Fe元素,且甲为氢氧化亚铁,乙为氢氧化铁。
(1)氮气的电子式为![]() ;氯元素的最高价氧化物的水化物的化学式为,故答案为:
;氯元素的最高价氧化物的水化物的化学式为,故答案为:![]() ;HClO4 ;
;HClO4 ;
(2)离子的电子层越多,离子半径越大,电子层数相同时,核电荷数越大,离子半径越小,M、Z、W分别形成的简单离子的半径由大到小顺序为S2->Cl->Na+;氯气能够将硫化氢氧化生成硫单质,说明元素氯比元素硫的非金属性强,故答案为:S2->Cl->Na+;H2S+Cl2=S2↓+HCl;
(3)氢氧化亚铁变为氢氧化铁的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4) 200mL 1mol·L-1的NaOH溶液中含有0.2molNaOH,标准状况下,4.48LSO2的物质的量为![]() =0.2mol,等物质的量的氢氧化钠和二氧化硫反应生成NaHSO3;此时溶液pH<7,说明电离程度大于水解程度,则其中含S元素的几种粒子的浓度由大到小的顺序为c(HSO3-)>c(SO32-)>c(H2SO3),故答案为:NaHSO3 ;c(HSO3-)>c(SO32-)>c(H2SO3);
=0.2mol,等物质的量的氢氧化钠和二氧化硫反应生成NaHSO3;此时溶液pH<7,说明电离程度大于水解程度,则其中含S元素的几种粒子的浓度由大到小的顺序为c(HSO3-)>c(SO32-)>c(H2SO3),故答案为:NaHSO3 ;c(HSO3-)>c(SO32-)>c(H2SO3);
(5)由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有H2O参与反应且有水生成,所以阴极上发生的电极反应式为:2NO3-+12H++10e-=N2+6H2O,故答案为:2NO3-+10e-+12H+=6H2O+N2↑。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有关如下反应的叙述正确的是
I :C(g)+H2O(g) ![]() CO(g)+H2(g) △H=+131.0kJ/mol
CO(g)+H2(g) △H=+131.0kJ/mol
II: CO(g) +H2O(g) ![]() CO2(g) + H2(g) △H=-43kJ/mol
CO2(g) + H2(g) △H=-43kJ/mol
III: CaO(s) + CO2(g)![]() CaCO3(s) △H =-178.3 kJ/mol
CaCO3(s) △H =-178.3 kJ/mol
IV: C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g) △H=akJ/mol
CaCO3(s)+2H2(g) △H=akJ/mol
A. a=+90.3
B. 恒温恒压下,在己达平衡的反应I体系中再充入少量He时平衡正向移动
C. 其他条件不变,加压对反应Ⅱ的反应速率无影响
D. 其他条件不变,升高温度可提高反应Ⅲ中CO2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯F是一种广泛用于香精的调香剂,其合成路线如下图所示:

已知:A的核磁共振氢谱有4组吸收峰,峰面积之比为3:3:2:2,E存在顺反异构,且既能与纯碱溶液反应又能使溴的CCl4溶液褪色。
(1)A的分子式为________。反应①、④的反应类型分别为_________、_______________。
(2)E所含官能团的名称:____________。
(3)写出下列反应的化学方程式:
反应⑤:______________________。
反应⑥:______________________。
(4)H的同分异构体有多种,属于芳香族化合物的(不含H)共______________种;
写出其中一种的结构简式:_______________________。
(5)M是G的同系物,比G的相对分子质量大14。请以M为原料(其他原料任选)
合成有机物:N: 。________________(在方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂)
。________________(在方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z和W代表原子序数依次增大的四种短周期主族元素.它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17。下列说法错误的是
A. X、Y、Z既能形成离子化合物.又能形成共价化合物
B. Y和Z元素的原子半径大小顺序为Y>Z
C. X与Y、Z之问形成的核外电子总数为10的微粒只有YX3和X2Z
D. Z、W元索的最简单氢化物的沸点和稳定性均为H2Z>H2W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某酸的酸式盐NaHY的水溶液的下列叙述中,正确的是
A. 该酸式盐的水溶液一定显酸性
B. 在该盐溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C. 若HY-能水解,水解方程式为:HY-+H2O![]() Y2-+H3O+
Y2-+H3O+
D. 若HY-能电离,电离方程式为:HY-+H2O![]() Y2-+H3O+
Y2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )

A.放电时,正极的电极反应式为O2+2H2O+4e-=4OH-
B.放电时,Li+透过固体电解质向Cu极移动
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒,在溶液中能大量共存的是( )
A.Ca2+、Cl﹣、CO32﹣、K+
B.Cu2+、Cl﹣、SO42﹣、OH﹣
C.K+、Cl﹣、NO3﹣、H+
D.H +、Cl﹣、CO32﹣、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向盛有50 mL pH=2的一元酸HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是

A. a→b的过程中,溶液中c(A-)与c(HA)之和始终不变
B. c点表示酸碱恰好完全反应
C. 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(OH-)>c(H+)
D. 25 ℃时,HA的电离平衡常数Ka约为1.43×10-3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com