
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=__________。
(2)0~2 s内该反应的平均速率v(NO)=__________, v(O2)=__________。
(3)能说明该反应已达到平衡状态的是__________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离出NO2气体 b.增大O2的浓度
c.扩大容器体积 d.选择高效催化剂
【答案】 K=![]() 3.0×10-3 mol/(L·s) 1.5×10-3 mol/(L·s) bc b
3.0×10-3 mol/(L·s) 1.5×10-3 mol/(L·s) bc b
【解析】(1)平衡常数表达式等于生成物的浓度幂之积比上反应物的浓度幂之积,K=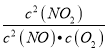 ;故答案为:K=
;故答案为:K=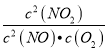 ;
;
(2)2s内用NO表示的平均反应速率v(NO)= ![]() =
=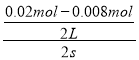 =3.0×10-3molL-1s-1,速率之比等于化学计量数之比,所以v(O2)=
=3.0×10-3molL-1s-1,速率之比等于化学计量数之比,所以v(O2)= ![]() v(NO)=
v(NO)= ![]() ×3.0×10-3molL-1s-1=1.5×10-3molL-1s-1,故答案为:3.0×10-3molL-1s-1;1.5×10-3molL-1s-1;
×3.0×10-3molL-1s-1=1.5×10-3molL-1s-1,故答案为:3.0×10-3molL-1s-1;1.5×10-3molL-1s-1;
(3)a.任何时候都存在v(NO2)=2v(O2),无法判断正逆反应速率是否相等,故a错误; b.反应前后气体体积不同,压强不变说明正逆反应速率相等,各组分浓度不变,故b正确;c.v逆(NO)=2v正(O2)时,说明一氧化氮正逆反应速率相等,反应达到平衡状态,故c正确; d.恒容容器,反应物生成物都是气体,质量不变,密度始终不变,所以密度不变不一定是平衡状态,故d错误;故选:bc;
(4)2NO(g)+O2(g)═2NO2(g)△H<0,反应是气体体积减小的放热反应。a.及时分离除NO2气体,减少生成物浓度,平衡正向进行,但反应速率减小,故a错误;b.增大O2的浓度,化学反应速率加快,平衡正向移动,故b正确;c.扩大容器体积,气体的压强减小,反应速率减慢,故c错误;d.选择高效催化剂,化学反应速率加快,平衡不移动,故d错误,故答案为:b。
点晴:注意只有反应前后不相同的量才能作为判断化学平衡的依据。反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化。反应前后不改变的量不能作为判断化学平衡的依据,如该反应中的气体的密度就不能作为判断化学平衡的依据。


科目:高中化学 来源: 题型:
【题目】在加热的条件下,用MnO2与100mL物质的量浓度为12mol/L的浓盐酸反应,制得氯气2.24L(标准状况).(已知MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O)
MnCl2+Cl2↑+2H2O)
(1)需要消耗MnO2多少克?
(2)被氧化的HCl的物质的量是多少?
(3)若反应后溶液的体积不变,则反应后溶液中Cl﹣物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.1 mol NH4+ 所含质子数为10NA
B.10克氖气所含原子数约为6.02×1023
C.标准状况下,22.4 L SO2所含的分子数为NA
D.常温常压下,32 g O2和O3的混合气体所含原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.在一定体积和一定条件下有反应N2(g)+3H2(g)![]() 2NH3(g),现分别从两条途径建立平衡:
2NH3(g),现分别从两条途径建立平衡:
Ⅰ.起始浓度N2:1 mol·L-1,H2:3 mol·L-1
Ⅱ.起始浓度N2:2 mol·L-1,H2:6 mol·L-1
则下列叙述正确的是( )
A. Ⅰ和Ⅱ两途径达到平衡时,体系内各成分的体积分数相同
B. 达到平衡时,途径Ⅰ的反应速率v(H2)等于途径Ⅱ的反应速率v(H2)
C. 达到平衡时,途径Ⅱ体系内混合气体的压强是途径Ⅰ内混合气体压强的2倍
D. 达到平衡时,途径Ⅰ体系内混合气体的密度为途径Ⅱ体系内混合气体的密度的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚硝酰(NOCl)具有强氧化性,易与水反应生成HCl和氮氧化物。实验室可通过反应Cl2+2NO![]() 2NOCl △H<0制备
2NOCl △H<0制备
回答下列问题:
(1)甲组同学拟用下图所示装置(夹持仪器未画出)拟制备Cl2和NO。

①制取Cl2时,分液漏斗中加入浓盐酸,则烧瓶中放入的固体药品可能是______。
②制取NO时,铜与稀硝酸反应的离子方程式为_________。
(2)乙组的同学制氯化亚硝酰(沸点为-5.5℃)的装置如下:
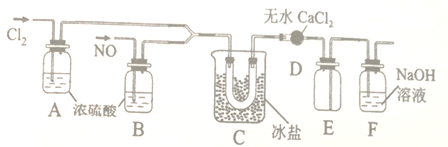
①装置D的作用是___________;装置E的作用是________。
②装置C中冰盐冷却的目的是___________(写两点)。
(3)丙组依据文献记载,氯化亚硝酰也可用NaNO2固体与气体制备,该反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】张青莲是我国著名的化学家,1991年他准确测得In的相对原子质量为114.818,被国际相对原子质量委员会采用为新的标准值.这是相对原子质量表中首次采用我国测定的相对原子质量值.则下列关于 ![]() In的说法中,错误的是( )
In的说法中,错误的是( )
A.![]() In原子核外有49个电子
In原子核外有49个电子
B.![]() In原子核内有49个中子
In原子核内有49个中子
C.![]() In原子核内质子数和中子数之和等于其质量数,为115
In原子核内质子数和中子数之和等于其质量数,为115
D.![]() In是In元素的一种核素
In是In元素的一种核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。
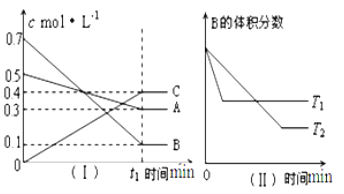
根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为_________,达到平衡时A的转化率为_____。T1____T2(大于,小于,等于),正反应为_____(填“吸热”或“放热”)反应。
(2)t1 min后,改变下列某一条件,能使平衡向逆反应方向移动的有___________(填字母编号)。
A.保持其他条件不变,增大压强
B.保持容器总体积不变,通入少量稀有气体
C.保持其他条件不变,升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20 .00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)________。
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,测定结果(填“偏大”、“偏小”或“无影响”)________。
(3)判断滴定终点的现象是:_________________________________________________。
(Ⅱ).室温时,pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
(4)如果加入蒸馏水,应加_________mL;
(5)如果加入pH=10的NaOH溶液,应加_________mL;
(6)如果加0.01mol/L HCl,应加_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图.下列说法正确的是( )
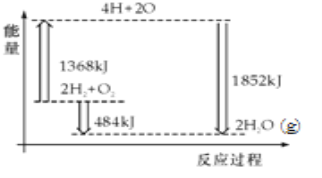
A. H2(g)和O2(g)反应生成H2O(g ),这是吸热反应
B. 2mol H2和1mol O2转化为4mol H、2mol O原子的过程中放出热量
C. 2mol H2(g)和1mol O2(g)反应生成2mol H2O(g),共放出484kJ能量
D. 4mol H、2mol O生成2mol H2O(g),共放出484kJ能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com