
| A. | H2的摩尔质量是2 g | B. | 1 mol H2O的质量是18 g/mol | ||
| C. | 氧气的摩尔质量是32 g/mol | D. | 2 g H2含1 mol H |
科目:高中化学 来源: 题型:实验题
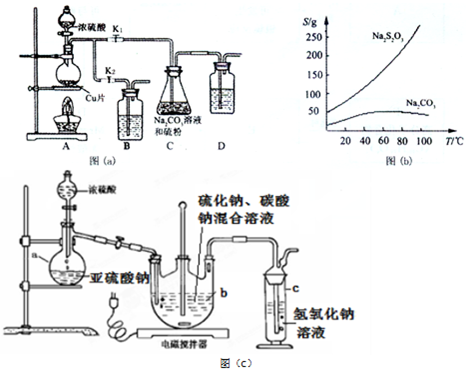
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1 | B. | 2.5 mol•L-1 | C. | 5 mol•L-1 | D. | 2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | NaCl | C. | CaO | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2 Al2(SO4)3 MgCl2 K2CO3 | B. | BaCl2 Na2SO4 (NH4)SO4 KOH | ||
| C. | AgNO3 NaCl KCl CuCl2 | D. | Fe2(SO4)3 K2CO3 KHSO4 NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 品名 | 浓缩菠萝汁 |
| 配料 | 水、浓缩菠萝汁、蔗糖、柠檬酸、甜蜜素、维生素C、菠萝香精、柠檬黄、日落黄、山梨酸钾等. |
| 性质 | 亚硝酸钠 | 氯化钠 |
| 1.酸性条件下的稳定性 | 微热时分解为NO和NO2 | 微热时不分解 |
| 2.熔点 | 271℃ | 801℃ |
| 3.室温时的溶解度 | 约80g | 约35g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(C2O42-)+c(HC2O4-)+c(OH-)=c(K+)+c(H+) | |
| B. | c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.2mol/L | |
| C. | c(C2O42-)<c(HC2O4-)<c(H2C2O4) | |
| D. | c(C2O42-)+c(HC2O4-)+c(H2C2O4)<c(K+) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9:2 | B. | 10:1 | C. | 11:1 | D. | 12:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com