
下列说法正确的是
A.Fe(OH)3胶体无色、透明,能产生丁达尔效应
B.SO3溶于水后得到的溶液可以导电,但SO3是非电解质
C.硫酸溶液的导电性一定比醋酸溶液的导电性强
D.用萃取分液的方法除去酒精中的水
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届河北省高三上期中化学卷(解析版) 题型:选择题
一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g) CH3OH(g) 达到平衡。下列说法正确的是
CH3OH(g) 达到平衡。下列说法正确的是
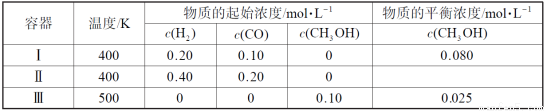
A.该反应的逆反应放热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上月考三化学试卷(解析版) 题型:选择题
已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1 mol/L NaHSO3和NaHCO3的两种溶液,两种溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的一组是 ( )
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(H+)+c(H2RO3)=c(HRO3-)+c(OH-)
C.c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、 c(RO32-) 分别相等
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上月考二化学卷(解析版) 题型:填空题
(1)实验室用Na2CO3?10H2O晶体配制0.05mol/L的Na2CO3溶液970mL,应选用的容量瓶的规格 ,称取Na2CO3?10H2O的质量是 g。
(2)2molO3和3molO2的质量之比为 ,分子数之比为 ,同温同压下的密度之比为 ,含氧原子数之比为 。
(3)现有下列九种物质①AgCl ②铜 ③液态醋酸 ④CO2 ⑤H2SO4 ⑥Ba(OH)2固体 ⑦酒精 ⑧稀硝酸 ⑨熔融FeCl3
①上述状态下可导电的是(填序号,下同) ,属于电解质的是 ,属于非电解质的是 。
②上述九种物质中有两种物质之间可发生离子反应H++OH-=H2O,该离子反应对应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上月考二化学卷(解析版) 题型:选择题
如图锥形瓶中装满了c mol/L的Na2SO4溶液,经测定其中含有 mol Na+,则锥形瓶容积为
mol Na+,则锥形瓶容积为

A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上期中选修化学卷(解析版) 题型:填空题
原子序数依次增大的X、Y、Z、W四种元素,X、Z基态原子的2p原子轨道上均有2个未成对电子, W基态原子的除第四层只有1个电子外,其余内层均为全满结构。
W基态原子的除第四层只有1个电子外,其余内层均为全满结构。
(1)W基态原子的价电子排布式为 。元素X、Y、Z的第一电离能由小到大顺序是 (填元素符号)。
(2)与XYZ-互为等电子体的一种分子为 (填化学式)。
(3)1 mol H2XZ3分子中含有σ键的数目为 。
(4)YH3极易 溶于水的主要原因是 。
溶于水的主要原因是 。
(5)尿素(H2NCONH2)可用于制有机铁肥,主要代表有 [Fe(H2NCONH2)6](NO3)3 [三硝酸六尿素合铁(Ⅲ)]。
①尿素分子中C、N原子的杂化方式分别是 。
②[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是 。根据价层电子对互斥理论推测NO3—的空间构型为 。

(6)CO2和NH3是制备尿素的重要原料,固态CO2(干冰)的晶胞结构如图所示。
①1个CO2分子周围等距离且距离最近的CO2分子有 个。
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上期中选修化学卷(解析版) 题型:选择题
下列各项叙述中,正确的是
A.分子晶体中不一定存在分子间作用力
B.价电子排布为4s24p1的元素位于第四周期第ⅠA族,是S区元素
C.已知金属钛的晶胞是面心立方结构(如图),则钛晶体1个晶胞中钛原子数为4个

D.水是一种非常稳定的化合物,这是由于氢键所导致
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上月考三化学试卷(解析版) 题型:填空题
氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料。
(1)下图是当反应器中按按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。

①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A.及时分离出NH3可以提高H2的平衡转化率
B.加催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、N、Q点平衡常数K的大小关系是K(M)= K(Q) >K(N)
③ M点对应的H2转化率是 。
(2)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO2时,溶液中的溶质为 。
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:

①氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是 。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方程式是 。
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上期中化学试卷(解析版) 题型:选择题
下列各情况,在其中Fe片腐蚀由快到慢的顺序是( )
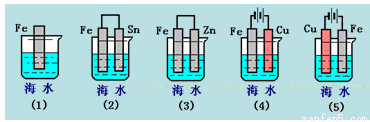
A.(5)(2)(1)(3)(4) B.(2)(5)(3)(4)(1)
C.(5)(3)(4)(1)(2) D.(1)(5)(3)(4)(2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com