
【题目】下列指定微粒的个数比为2∶1的是( )。
A.Be2+中的质子和电子
B.H原子中的中子和质子
C.NaHCO3中的阳离子和阴离子
D.BaO2(过氧化钡)固体中的阴离子和阳离子
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中,一定能大量共存的是( )
A. 无色溶液中:[Al(OH)4]-、K+、OH-、NO![]()
B. 能与铝片反应产生氢气的溶液中:Al3+、Cl-、Fe2+、NO![]()
C. 常温下,pH=2的溶液中:SO![]() 、Cl-、K+、SiO
、Cl-、K+、SiO![]()
D. 含有较多Fe3+的溶液中:Na+、SO![]() 、SCN-、I-
、SCN-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2===2NO,经测定前3 s用N2表示的反应速率为0.1 mol/(L·s),则6 s末NO的浓度为
A. 1.2 mol/L B. 大于1.2 mol/L C. 小于1.2 mol/L D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知常温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,则该溶液的pH= ,此酸的电离平衡常数K= ,由HA电离出的H+的浓度约为水电离出的H+的浓度的 倍。
(2)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶剂。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
①向该溶液中加入少量盐酸时,发生反应的离子方程式是 ,向其中加入少量KOH溶液时,发生反应的离子方程式是 。
②现将0.04mol﹒L-1HA溶液和0.02mol﹒L-1NaOH溶液等体积混合,得到缓冲溶液。
a、若HA为HCN,该溶液显碱性,则溶液中c(Na+) c(CN-)(填“<”、“=”或“>”)。
b、若HA为CH3COOH,该溶液显酸性,溶液中所有的离子按浓度由大到小排列的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na2SO4 和 Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1mol/L,SO42-浓度为0.3mol/L,则混合溶液中Na+的浓度为
A.0.15mol/L B.0.45mol/L C.0.6mol/L D.0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,X、Y、Z、R为短周期元素,其中Y元素的原子最外层电子数是其内层电子数的3倍。下列说法正确的是
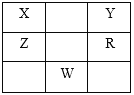
A. 原子半径大小关系为: R> Y > X
B. X有多种同素异形体,而Y不存在同素异形体
C. 根据元素周期律,可以推测W元素的单质具有半导体特性,W2Y3具有氧化性和还原性
D. ZY2晶体熔化、液态RY3气化均需克服分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物的合成与结构修饰是制备具有特殊功能材料的重要过程。下图是合成具有特殊功能高分子材料W(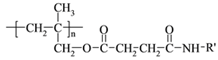 )的流程:
)的流程:
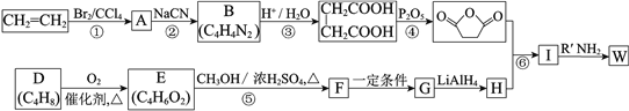
已知:(R、R1、R2代表烃基)
I、![]()
![]() RCH2OH
RCH2OH
II、![]()
⑴反应①的反应类型是_______________。
⑵反应②是取代反应,其化学方程式是___________________________________________。
⑶D的核磁共振氢谱中有两组峰且面积之比是1:3,不存在顺反异构。D的结构简式是______。
⑷反应⑤的化学方程式是__________________________________________________。
⑸G的结构简式是__________________。
⑹反应⑥的化学方程式是__________________________________________________。
⑺工业上也可用![]() 合成E。由上述①~④的合成路线中获取信息,完成下列合成路线(箭头上注明试剂和反应条件,
合成E。由上述①~④的合成路线中获取信息,完成下列合成路线(箭头上注明试剂和反应条件,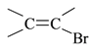 不易发生取代反应)__________________
不易发生取代反应)__________________
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com