
| A. | 20℃时,AgCl固体在等物质的量浓度的NaCl、MgCl2溶液中的溶度积相同 | |
| B. | 浓度为0.2mol/L的KHCO3溶液:c(H2CO3)>c(CO32-) | |
| C. | a mol/LHCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b | |
| D. | 常温下,在0.1mol/L的NaOH溶液中,由水电离出的c(H+)<$\sqrt{{K}_{W}}$ |
分析 A.难溶物溶度积与温度有关,温度不变溶度积不变;
B.碳酸氢钾溶液溶液呈碱性,说明碳酸氢根离子的水解程度大于其电离程度;
C.c(Na+)>c(CN-),根据电荷守恒可知c(H+)<c(OH-),溶液呈碱性,结合a=b时分析;
D.氢氧化钠溶液抑制了水的电离,则由水电离出的c(H+)<$\sqrt{{K}_{W}}$.
解答 解:A.溶度积与温度有关,所以20℃时AgCl固体在等物质的量浓度的NaCl、MgCl2溶液中的溶度积相同,故A正确;
B.浓度为0.2mol/L的KHCO3溶液呈碱性,说明HCO3-的水解程度大于其电离程度,则c(H2CO3)>c(CO32-),故B正确;
C.a mol/LHCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),根据电荷守恒可知c(H+)<c(OH-),溶液呈碱性;当a=b时二者恰好反应生成强碱弱酸盐NaCN,所以当c(Na+)>c(CN-)时a不一定大于b,故C错误;
D.常温下纯水中由水电离出的c(H+)=c(OH-)=$\sqrt{{K}_{W}}$,由于KOH溶液抑制了水的电离,导致水的电离程度减小,则由水电离出的c(H+)<$\sqrt{{K}_{W}}$,故D正确;
故选C.
点评 本题考查较为综合,题目难度中等,涉及难溶物溶度积判断、盐的水解原理、酸碱混合的定性判断、水的电离及其影响等知识,注意掌握化学平衡及其影响,明确水的电离及其影响因素,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 颜色和状态 | 硬度 | 密度 | 熔点 | 导电性 | 导热性 | 延展性 |
| 银白色固体 | 较软 | 2.70g•cm-3 | 660.4℃ | 良好 | 良好 | 良好 |
| 一种猜想 | 验证方法 | 现象 | 结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 性状 | 相对分 子质量 | 溶解度 | |||
| 冷水 | 热水 | 乙醇 | 乙醚 | |||
| 呋喃甲醛 | 无色液体 | 96 | 微溶 | 易溶 | 易溶 | 互溶 |
| 呋喃甲醇 | 无色液体 | 98 | 互溶 | 互溶 | 易溶 | 易溶 |
| 呋喃甲酸 | 无色晶体 | 112 | 微溶 | 易溶 | 可溶 | 易溶 |
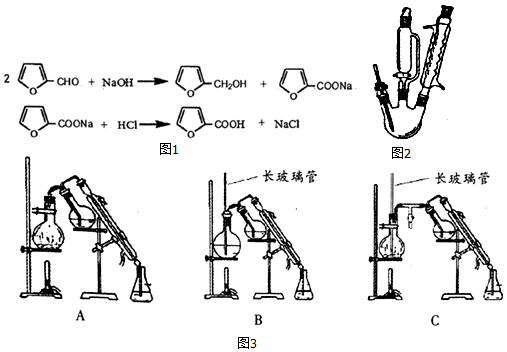
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
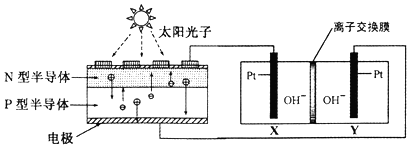
| A. | 图中N型半导体为负极,P型半导体为正极 | |
| B. | 图中离子交换膜为阴离子交换膜 | |
| C. | 反应完毕,该装置中电解质溶液的碱性增强 | |
| D. | 人体呼出的气体参与X电极的反应:CO2+2e一+H2O=CO+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | mg该磁黄铁矿中含+2价的铁0.75mol | |
| B. | 200mL盐酸中HCl物质的量浓度为4.25mol•L-1 | |
| C. | 生成的H2S气体在标准状况下的体积为16.8L | |
| D. | 该磁黄铁矿中Fe1-nS的n=0.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该气体的摩尔质量为34 | B. | 500ml溶液物质的量浓度为2mol/L | ||
| C. | 标况下该气体的摩尔体积为22.4 L | D. | 17克该气体物质的量为0.5mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com