

分析 本题是结合酸碱中和原理和滴定实验操作探究食醋的总酸量,对滴定的原理和操作进行了分析,因醋酸是弱酸,离子反应式中不改写,完全中和时得到的是醋酸钠溶液显碱性,应选择酚酞作指示剂等,另外还探究了用强碱氢氧化钠溶液滴定强酸和弱酸的比照实验,并对过程进行了分析,涉及了弱酸根离子的水解知识,据此可解答;
(1)a.醋酸为弱电解质,离子方程式中应写为化学式;
b.实验时,为减小误差,应降低溶液的浓度;
c.不能用甲基橙为酸碱指示剂;
d.食醋的物质的量浓度为0.75mol•L-1,总酸量为0.75mol•L-1×60g/mol=45g/L,即4.5g/100mL;
(2)醋酸为弱电解质,滴定终点时,醋酸钠溶液水解,使溶液呈碱性;
解答 解:(1)a.醋酸为弱电解质,离子方程式应为CH3COOH+OH-=H2O,故a错误;
b.食醋试样需稀释一定倍数后再进行滴定,目的为减小实验误差,故b正确;
c.醋酸为弱电解质,滴定终点时,溶液呈碱性,不能用甲基橙为酸碱指示剂,否则误差较大,故c错误;
d.食醋的物质的量浓度为0.75mol•L-1,总酸量为0.75mol•L-1×60g/mol=45g/L,即4.5g/100mL,故d正确.
故答案为:bd;
(2)①醋酸为弱电解质,滴定过程中pH变化较盐酸缓慢,滴定终点时溶液呈碱性,则滴定醋酸溶液的曲线是图2,滴定终点时n(CH3COOH)=n(NaOH),则a=20.00mL,故答案为:图2;20.00;
②醋酸钠为强碱弱酸盐,因水解CH3COO-+H2O?CH3COOH+OH-,使得溶液pH=8,呈碱性,故答案为:碱;醋酸钠;
点评 本题综合考查物质的含量测定、酸碱混合的定性判断和计算,题目难度中等,但信息量较大,答题时注意审题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4L氧气所含的原子数为2NA | |
| B. | 17g的OH-离子中含有的电子数为9NA | |
| C. | 常温常压下,44gCO2含有的氧原子数为2NA | |
| D. | 标准状况下,11.2L四氯化碳所含分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | R | W | X | Y | Z | 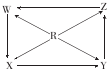 |
| A | Si | SiO2 | H2SiO2 | Na2SiO2 | SiCl4 | |
| B | Na | Na2O | Na2O2 | Na2CO3 | NaOH | |
| C | Fe | Fe(OH)2 | FeCl3 | FeCl3 | Fe(NO4)3 | |
| D | Al | NaAlO2 | Al2(SO4)3 | AlCl3 | Al(NO4)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮罐贮运浓硫酸 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 检验Fe(NO3)2晶体是否已氧化变质,将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 | |
| D. | 常温下将Al片放入浓硝酸中,无明显变化,所以Al与浓硝酸不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示装置Ⅰ是一种可充电电池,装置Ⅱ为NaCl和酚酞和混合溶液浸湿的滤纸,离子交换膜只允许Na+通过,电池充电、放电的化学方程式为2Na2S2+NaBr3$\frac{\underline{\;放电\;}}{充电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )
如图所示装置Ⅰ是一种可充电电池,装置Ⅱ为NaCl和酚酞和混合溶液浸湿的滤纸,离子交换膜只允许Na+通过,电池充电、放电的化学方程式为2Na2S2+NaBr3$\frac{\underline{\;放电\;}}{充电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )| A. | 电池充电时,电极B连接直流电源的正极 | |
| B. | 电池放电过程中Na+从左到右通过离子交换膜 | |
| C. | 闭合开关K后,b电极附近pH变小 | |
| D. | 当b电极上析出气体1120mL(标准状况)时,有0.1 molNa+通过离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、N2、NO、NO2 | B. | NO、NO2、N2O、N2O3 | ||
| C. | N2、N2O、NO2、N2O5 | D. | NH3、NO2、N2O4、HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com