
| A. | NaOH | B. | FeCl3 | C. | Na2CO3 | D. | NaCl |
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
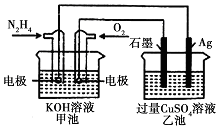
| A. | 该装置工作时,Ag电极上有气体生成 | |
| B. | 甲池和乙池中的溶液的pH均减小 | |
| C. | 甲池中负极反应为N2H4-4e-═N2+4H+ | |
| D. | 当甲池中消耗0.1molN2H4时,乙池中理沦上最多产生6.4g固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 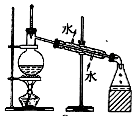 装置常用于分离互不相溶的液体混合物 | |
| B. | 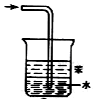 装置可用于吸收氨气,且能防止倒吸 | |
| C. | 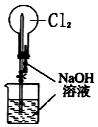 用装置不可以完成“喷泉”实验 | |
| D. | 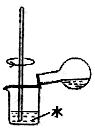 用装置稀释浓硫酸和铜反应冷却后的混合液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠和氧气反应,条件不同,产物则不同 | |
| B. | 钠长期放置在空气中,最终将变成碳酸钠 | |
| C. | 钠的化学性质比较活泼,少量的钠可以保存在与钠不反应的煤油中 | |
| D. | 将一小块钠投入氯化铁溶液时,既能产生气体又会出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com