
【题目】下列离子方程式书写正确的是( )
A. 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B. 铁片与氯化铜溶液反应:Fe+Cu2+=Cu+Fe2+
C. 氢氧化镁溶于盐酸:Mg(OH)2+H+=Mg2++H2O
D. Cu(OH)2与稀硫酸反应:![]()
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 某温度时,1LpH = 6的水溶液,含1.0×10-6molOH-离子
B. 含10.6g Na2CO3溶液中,所含阴离子总数等于0.1mol
C. 用TiCl4制备TiO2:TiCl4 +(x+2) H2O(过量)= TiO2·xH2O↓+ 4HCl
D. 用弱酸溶液滴定强碱溶液时可用甲基橙作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中溶质的物质的量浓度为1 mol/L的是( )
A. 将40gNaOH固体溶于1L水中
B. 将22.4 L氯化氢气体溶于水配成1L溶液
C. 将1L 10mol/L的浓盐酸与9L水混合
D. 将10g NaOH固体溶解在水中配成250 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K4[Fe(CN)6]可用于生产油漆、药物等。
(1)Fe2+的核外电子排布式为_____。
(2)CN﹣中C原子轨道的杂化类型为_____。与CN﹣互为等电子体的一种分子的结构式为_____。
(3)[Cu(H2O)4]2+结构示意图如图所示。[Fe(CN)6]4﹣结构示意图如图所示,请在图中相应位置补填配体_________。

(4)已知3K4Fe(CN)6![]() 12KCN+Fe3C+3C+(CN)2↑+2N2↑.(CN)2分子中σ键与π键的数目比n(σ):n(π)=_____。
12KCN+Fe3C+3C+(CN)2↑+2N2↑.(CN)2分子中σ键与π键的数目比n(σ):n(π)=_____。
(5)铁触媒是合成氨反应的催化剂,其表面存在氮原子。氮原子在铁表面上的单层附着局部示意如图所示。则铁表面上氮原子与铁原子的数目比为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以芳香化合物A为原料制备灭鼠剂氟鼠酮中间体(G)的一种合成路线如下:

回答下列问题:
(1)A的化学名称是________;A→B的试剂及反应条件依次是________。
(2)E→F的反应类型是________。
(3)D的结构简式为________。
(4)G中的含氧官能团名称为________。
(5)芳香化合物X是F的同分异构体,X能发生银镜反应和水解反应,核磁共振氢谱有4组峰且峰面积之比为6︰6︰1︰1,写出一种符合上述条件的X的结构简式:________。
(6)PES(聚丁二酸乙二醇酯)是一种可生物降解型聚酯,设计以1,2-二氯乙烷为初始原料制备PES的合成路线:________(无机试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列转化过程的化学方程式。单质、氧化物、酸、碱和盐的相互关系,可以用下图简单表示,限选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转变用化学方程式表示(所写化学方程式不得重复)。
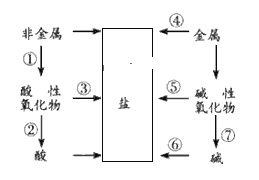
①______,②_______,③_______,④________,⑤____,⑥_______,⑦______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B=3C+4D反应中,表示该反应速率最快的数据是
A. v(A)=0.5mol·L-1·s-1 B. v(B)=3mol·L-1·min-1
C. v(C)=0.9mol·L-1·s-1 D. v(D)=1.0mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为H2与O2反应生成H2O(g)的能量变化示意图:

下列有关叙述不正确的是
A. 1molH2分子断键需要吸收436kJ的能量
B. H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8kJ/mol
C. 分解1mol气态水生成氢气和氧气总共需要吸收926.8kJ的热量
D. 形成化学键释放的总能量比断裂化学键吸收的总能量大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、硫及其化合物在工农业生产生活中有着重要作用。回答下列问题:
(1)有人设想利用CO还原SO2。已知S和CO的燃烧热分别是296.0 kJ·mol1、283.0 kJ·mol1,请写出CO还原SO2的生成CO2和S(s)热化学方程式___________________________________。
(2)某科研小组研究臭氧氧化碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+O3(g)![]() NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
反应Ⅱ:SO2(g)+O3(g)![]() SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
已知该体系中臭氧发生分解反应:2O3(g)![]() 3O2(g)。请回答:
3O2(g)。请回答:
其它条件不变,每次向容积为2 L的反应器中充入含2.0 mol NO、2.0 mol SO2的模拟烟气和4.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:

①由图1可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_______。
②下列说法正确的是________。
A.Q点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若扩大反应器的容积可提高NO和SO2的转化率
D.臭氧氧化过程不能有效地脱除SO2,但后续步骤碱吸收可以有效脱硫
③假设100℃时P、Q均为平衡点,此时反应时间为5min,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是________mol;SO2的平均反应速率为________;反应Ⅰ在此时的平衡常数为_______________。
(3)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

①ab是_______离子交换膜(填“阳”或“阴”)。阴极区的电极反应式为_____________。
②若NO吸收转化后的产物为NH4+,通电过程中吸收4.48LNO(标况下),则阳极可以产生____mol气体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com