
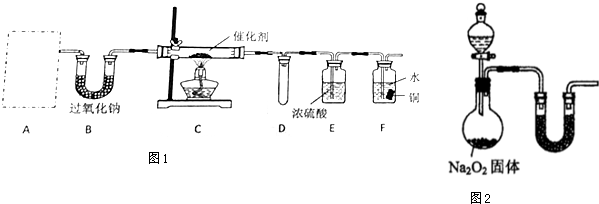
分析 4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,进行氨的催化氧化实验,需氨气和氧气,氨气用碳酸氢铵制备,氧气用二氧化碳与过氧化钠反应制备,氨气和氧气催化氧化需用铂粉作催化剂,一氧化氮二氧化氮都是空气污染物,所以需进行尾气吸收;
(1)①根据碳酸氢铵,受热分解生成NH3、CO2和H2O选择仪器;
②根据碳酸氢铵受热分解的产物以及过氧化钠的性质分析解答;
③NH3与O2在催化剂、加热条件下发生反应生成一氧化氮和水;
④若A、B中药品足量,则进入装置F中的气体为一氧化氮、氧气的混合气体,4NO+3O2+2H2O=4HNO3,硝酸能将铜氧化;
⑤该装置存在的主要缺陷是,F中液体因为压强变化的关系可能会倒吸,一氧化氮以及生成的二氧化氮均有毒,据此分析实验装置的优劣;
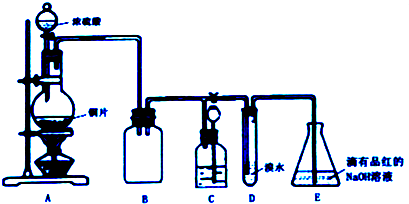
(2)①根据甲小组的装置中A、B部分用途分析替代装置,氨气是碱性气体,极易溶于水,做氨气干燥剂的物质不能和氨气反应,所以干燥氨气的物质应为碱性或中性;
②过氧化钠和氨水中水反应生成氢氧化钠和氧气,反应放热,促进平衡逆向进行,NH3+H2O?NH3•H2O?NH4++OH-,利于放出氨气.
解答 解:(1)①若A中使用的药品是NH4HCO3固体,加热NH4HCO3固体需要酒精灯,故答案为:b;
②装置B中盛放过氧化钠,碳酸氢铵受热分解生成NH3、CO2和H2O,过氧化钠和水反应2Na2O2+2H2O=4NaOH+O2↑,该反应能提供氧气,二氧化碳与过氧化钠,2Na2O2+2CO2═2Na2CO3+O2,该反应也能提供氧气,所以装置B的作用是与水和二氧化碳反应,产生C中所需的反应物氧气,
故答案为:与水和二氧化碳反应,产生C中所需的反应物氧气;
③NH3与过量O2在催化剂、加热条件下发生反应生成一氧化氮和水,反应方程为4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;
④若A、B中药品足量,则进入装置F中的气体为一氧化氮、氧气的混合气体,4NO+3O2+2H2O=4HNO3,硝酸能将铜氧化,反应现象为:铜片逐渐溶解,表面有气泡产生,溶液逐渐变蓝,液面上方气体逐渐变红棕色,
故答案为:铜片逐渐溶解,表面有气泡产生,溶液逐渐变蓝,液面上方气体逐渐变红棕色;
⑤该装置存在的主要缺陷是,F中液体因为压强变化的关系可能会倒吸,一氧化氮以及生成的二氧化氮均有毒,应加一个尾气吸收装置,
故答案为:F中液体可能会倒吸,尾气产生的NO2会污染环境;
(2)①A装置提供二氧化碳、水蒸气、氨气,装置B为干燥氨气,所以当有过氧化钠存在时需用浓氨水,省略了将二氧化碳、水蒸气转化成氧气,氨气为碱性气体,干燥氨气的物质应为碱性或中性需选用碱石灰(或氢氧化钠、氧化钙),
故答案为:浓氨水;碱石灰(或氢氧化钠、氧化钙);
②过氧化钠和氨水中水反应生成氢氧化钠和氧气,反应放热,氨水中存在NH3+H2O?NH3•H2O?NH4++OH-,碱石灰与水反应产生OH-并放出大量热量,使平衡左移,利于NH3释放,
故答案为:氨水中存在NH3+H2O?NH3•H2O?NH4++OH-,碱石灰与水反应产生OH-并放出大量热量,使平衡左移,利于NH3释放.
点评 本题主要考查了氨气的催化氧化,解答须根据题目中提供的药品和装置结合该反应的原理和相关物质的性质,题目难度中等.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:实验题
| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 滴加少量淀粉碘化钾溶液,振荡 | III | |
| ② | 滴加少量棕红色的KI3溶液,振荡 | II | |
| ③ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
| ④ | 加入几小块CaCO3固体 | 有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
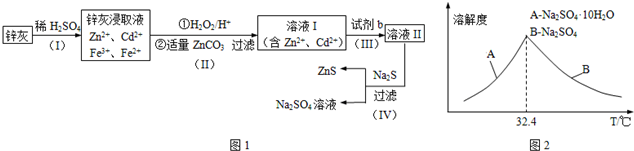
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②④ | C. | ②④⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
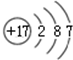 ②
②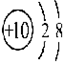 ③
③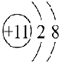 ④
④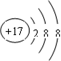
| A. | ①②两种粒子所属的元素在元素周期表的同一横行 | |
| B. | ②③④对应的元素化学性质相似 | |
| C. | ①③对应的元素是同一周期元素 | |
| D. | ③④可形成X2Y型化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L CH3COOH溶液 | B. | 0.01mol/L HNO3溶液 | ||
| C. | pH=2的H2SO4溶液 | D. | pH=2的CH3COOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com