
| A. | 除去NaHCO3溶液中少量的Na2CO3:通入过量的CO2 | |
| B. | 除去MgCl2溶液中少量的AlCl3:加入过量氢氧化钠溶液,过滤,用蒸馏水洗涤沉淀后用稀盐酸溶解沉淀 | |
| C. | 除去K2CO3固体中少量NaHCO3:置于坩埚中加热 | |
| D. | 用盐酸除去AgCl中少量的Ag2CO3 |
分析 A、碳酸钠和二氧化碳、水反应生成碳酸钠;
B、加入过量氢氧化钠溶液,Al3+生成偏铝酸根,过滤得到氢氧化镁沉淀,加盐酸溶沉淀解,得到氯化镁;
C、加热NaHCO3生成Na2CO3;
D、盐酸和碳酸银反应生成氯化银、二氧化碳和水.
解答 解:A、碳酸钠和二氧化碳、水反应生成碳酸钠,把杂质转化为NaHCO3溶液的溶质,故A正确;
B、加入过量氢氧化钠溶液,Al3+生成偏铝酸根,过滤得到氢氧化镁沉淀,加盐酸溶解沉淀,得到氯化镁,故B正确;
C、加热NaHCO3生成Na2CO3,仍然是K2CO3固体的杂质,故C错误;
D、盐酸和碳酸银反应生成氯化银、二氧化碳和水,除去了碳酸银,故D正确;
故选C.
点评 本题考查了除杂操作的基本原则,以及钠的重要化合物的化学性质,难度不大.


科目:高中化学 来源: 题型:填空题
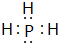 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 部分结构知识 | 部分性质 |
| X | X原子核外电子占有9个原子轨道 | X的一种氧化物是形成酸雨的主要物质 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1 mol•L-1的KClO3溶液中,K+的个数为NA | |
| B. | 在标准状况下,22.4 L CH3CH2OH的分子数为NA | |
| C. | 32 g氧气和臭氧的混和气体中含有的氧原子数为2NA | |
| D. | 22.4 L HCl气体中含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25mol | B. | 2.5mol | C. | 0.15mol | D. | 1.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0 kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | Ba(OH)2•8H2O与NH4Cl反应的焓变小于0,所以在常温下能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
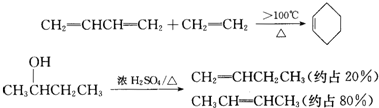

 ;C
;C ;D
;D .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,BN中B元素的化合价为+3;
,BN中B元素的化合价为+3; ,其二氯代物有4种.
,其二氯代物有4种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com