
【题目】实验室用如图所示装置制备FeSO4溶液,再与等物质的量的(NH4)2SO4反应,制备补血剂硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]。
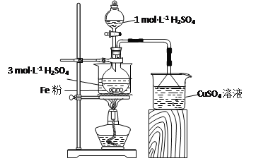
已知:硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
(1)实验装置
反应过程中会产生少量PH3气体,需使用封闭装置。用CuSO4溶液吸收PH3时会生成H3PO4和Cu。该反应的化学方程式为___。
(2)药品用量
将2gFe粉、10mL3mol·L-1H2SO4溶液加入烧瓶中反应。采取该原料配比的主要原因是___。
(3)制备FeSO4溶液
保持温度70~80℃,至反应无明显气泡产生,停止加热,过滤,称量残留固体质量。为避免在上述过程中析出FeSO4晶体,可采取的措施有__。
(4)制备(NH4)2Fe(SO4)2·6H2O
①向FeSO4溶液中加入一定质量的(NH4)2SO4固体,70~80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。乙醇的作用为___。
②为防止Fe2+被氧化,可采取的主要措施有__(填字母)。
a.(NH4)2SO4固体不配成溶液,直接加入到FeSO4溶液中
b.混合液不蒸发浓缩,直接倒入无水乙醇中析出晶体
c.析出的晶体不用水洗,用90%的乙醇溶液洗涤
d.将实验中所用的乙醇回收,蒸馏后重复使用
(5)产品检验
请补充完整测定产品中SO42-含量的实验方案:准确称取约0.4g样品,溶于70mL水,__,将沉淀移入坩埚,灼烧至恒重,记录数据(实验中须使用的试剂有:2mol·L-1HCl溶液、BaCl2溶液、AgNO3溶液)。
【答案】4CuSO4+PH3+4H2O=H3PO4+4H2SO4+4Cu↓ 避免Fe2+被氧化为Fe3+ 通过分液漏斗及时添加适量1mol·L-1H2SO4溶液;趁热过滤 降低硫酸亚铁铵在水中溶解的量 ab 加入2mol·L-1HCl溶液酸化,滴加BaCl2溶液至沉淀完全,过滤,洗涤沉淀,直至滤液滴加AgNO3溶液不出现浑浊
【解析】
(1)用CuSO4溶液吸收PH3时会生成H3PO4和Cu,结合电荷守恒和原子守恒书写化学方程式;
(2)Fe2+易被氧化;
(3)通过分液漏斗及时添加适量1mol·L-1H2SO4溶液或趁热过滤,避免在过程中析出FeSO4晶体;
(4)①可以降低硫酸亚铁铵在水中的溶解量;
②为防止Fe2+被氧化,硫酸铵固体可以不配成溶液,直接倒入硫酸亚铁中,混合溶液也可以不蒸发浓缩,直接倒入无水乙醇中析出晶体;
(5)实验首先需要将硫酸根完全转化为硫酸钡沉淀,通过称量沉淀的质量计算硫酸根离子的含量,需要先加入盐酸酸化,排除其它离子的干扰,防止其它沉淀生成,沉淀灼烧前需要洗涤沉淀保证沉淀表面无滤液中的离子,可以用硝酸银溶液检验洗涤液,确定Cl-是否存在。
(1)实验装置反应过程中会产生少量PH3气体,需使用封闭装置,用CuSO4溶液吸收PH3时会生成H3PO4和Cu。该反应的化学方程式是:4CuSO4+PH3+4H2O=H3PO4+4H2SO4+4Cu↓;
(2)药品用量将2gFe粉、10mL3mol·L-1H2SO4溶液加入烧瓶中反应,反应中铁是过量的,依据Fe2+的性质可得,采取该原料配比的主要原因是:避免Fe2+被氧化为Fe3+;
(3)制备FeSO4溶液保持温度70~80℃,至反应无明显气泡产生,停止加热,过滤,称量残留固体质量,依据FeSO4的性质可得,为避免在上述过程中析出FeSO4晶体,可采取的措施有:通过分液漏斗及时添加适量1mol·L-1H2SO4溶液,使溶液浓度降低,还需要趁热过滤,防止晶体在过滤过程中析出;
(4)①向FeSO4溶液中加入一定质量的(NH4)2SO4固体,70~80℃条件下溶解后,趁热倒入50mL乙醇中的原因是硫酸亚铁铵不溶于乙醇,可以析出晶体。乙醇的作用为:降低硫酸亚铁铵在水中溶解的量;
② a.(NH4)2SO4固体不配成溶液,直接加入到FeSO4溶液中,可以防止在溶解固体的过程中,溶液中溶解氧气,进而氧化亚铁离子,正确;
b.蒸发浓缩过程中亚铁离子容易被空气中的氧气氧化,硫酸亚铁铵不溶于乙醇,所以可以直接倒入无水乙醇中析出晶体,防止亚铁离子被氧化,正确;
c.析出的晶体不用水洗,用90%的乙醇溶液洗涤,是为了防止溶解损失,错误;
d.将实验中所用的乙醇回收,蒸馏后重复使用,是为了节约药品,错误;
答案选ab;
(5)测定产品中SO42-含量的实验方案是:准确称取约0.4g样品,溶于70mL水,加入2mol·L-1HCl溶液酸化,滴加BaCl2溶液至沉淀完全,过滤,洗涤沉淀,直至滤液滴加AgNO3溶液不出现浑浊,将沉淀移入坩埚,灼烧至恒重,记录数据。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。下列有关说法正确的是( )
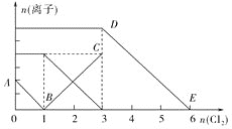
A.线段AB代表Fe2+物质的量的变化情况
B.线段BC代表Fe3+物质的量的变化情况
C.线段DE所发生的离子反应方程式为2Fe2++Cl2===2Fe3++2Cl-
D.原溶液中n(Fe2+)∶n(I-)∶n(Br-)=1∶2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全。确定分解产物的成分。

(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和___。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中定有___气体产生,写出D中发生反应的离子方程式__。若去掉C,是否能得出同样结论并解释其原因___。
(3)为验证A中残留物是否含有FeO,需要选用的试剂有___。
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
(4)已知分解产物中的某气体能使紫色石蕊试液变蓝,该气体被氧气连续氧化为红棕色气体,第一步催化氧化的化学反应方程式为:__。
(5)上述红棕色气体易溶于水,当该气体与氧气按5:1的体积比混合后装满试管倒置于水中,待液面稳定后试管中的气体体积变为原体积的__。
(6)E中收集到的气体只有N2,其物质的量为xmol,固体残留物Fe2O3的物质的量为ymol,D中沉淀物质的量为zmol,根据氧化还原反应的基本规律,x、y和z应满足的关系为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积可变密闭容器中,加入一定量的X、Y,发生反应mX(g)![]() nY(g) ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g) ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:

下列说法正确的是
A.m<n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中所含氧原子的物质的量相同的是( )
A.0.3mol O2和0.3mol H2OB.![]() 个
个![]() 与0.1mol
与0.1mol ![]()
C.0.1mol ![]() 与0.15mol
与0.15mol ![]() D.0.1mol
D.0.1mol ![]() 与0.1mol
与0.1mol ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,把1molN2和3molH2通入一个一定容积的密闭的容器里,发生如下反应:N2+3H2![]() 2NH3;当此反应进行到一定程度时,反应混和物就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c分别代表初始加入的N2、H2和NH3的物质的量(mol)。如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同。请填写下列空白:
2NH3;当此反应进行到一定程度时,反应混和物就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c分别代表初始加入的N2、H2和NH3的物质的量(mol)。如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同。请填写下列空白:
(1)若a=0,b=0,则c=__________。
(2)若a=0.5,则b=__________和c=__________。
(3)a、b、c取值必须满足的一般条件是:请用两个方程式表示,其中一个只含a和c,另一个只含b和c______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镓(GaN)被称为第三代半导体材料,其应用已经取得了突破性的进展。
已知:(i)氮化镓性质稳定,不与水、酸反应,只在加热时溶于浓碱。
(ii)NiCl2 溶液在加热时,先转化为Ni(OH)2,后分解为NiO。
(iii)制备氮化镓的反应为:2Ga+2NH3![]() 2GaN+3H2
2GaN+3H2
某学校化学兴趣小组实验室制备氮化镓,设计实验装置如图所示:

设计实验步骤如下:
①滴加几滴NiCl2 溶液润湿金属镓粉末,置于反应器内。
②先通入一段时间后的H2,再加热。
③停止通氢气,改通入氨气,继续加热一段时间。
④停止加热,继续通入氨气,直至冷却。
⑤将反应器内的固体转移到盛有盐酸的烧杯中,充分反应过滤、洗涤、干燥。
(1)仪器X中的试剂是___________,仪器Y的名称是__________________。
(2)指出该套装置中存在一处明显的错误是________________________。
(3)步骤①中选择NiCl2 溶液,不选择氧化镍的原因是____________________。
a.增大接触面积,加快化学反应速率
b使镍能均匀附着在镓粉的表面,提高催化效率
c.为了能更好形成原电池,加快反应速率
(4)步骤③中制备氮化镓,则判断该反应接近完成时观察到的现象是____________________。
(5)请写出步骤⑤中检验产品氮化镓固体洗涤干净的操作________________________。
(6)镓元素与铝同族,其性质与铝类似,请写出氮化镓溶于热NaOH溶液的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() 的说法正确的是
的说法正确的是
A. 所有碳原子可能共平面 B. 除苯环外的碳原子共直线
C. 最多只有4个碳原子共平面 D. 最多只有3个碳原子共直线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com