
【题目】铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1) 由辉铜矿制取铜的反应过程为:
2Cu2S(s)+3O2(g)===2Cu2O(s)+2SO2(g) ΔH=-768.2 kJ·mol-1,
2Cu2O(s)+Cu2S(s)===6Cu(s)+SO2(g) ΔH=+116.0 kJ·mol-1,
①热化学方程式:Cu2S(s)+O2(g)===2Cu(s)+SO2(g) ΔH= ________kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作________极。
(2) 氢化亚铜是一种红色固体,可由下列反应制备:4CuSO4+3H3PO2+6H2O===4CuH↓+4H2SO4+3H3PO4。
①该反应还原剂是____________(写化学式)。
②该反应每转移3 mol电子,生成CuH的物质的量为________。
(3) 氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-)的关系如图所示。
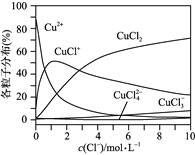
①当c(Cl-)=9 mol·L-1时,溶液中主要的3种含铜物种的浓度大小关系为__________________________。
②在c(Cl-)=1 mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为___________________________,___________________________(任写两个)。
【答案】 -217.4 阳 H3PO2 1 mol c(CuCl2)>c(CuCl+)>c(CuCl) CuCl++Ag+===AgCl↓+Cu2+ CuCl2+Ag+===CuCl++AgCl↓或CuCl2+2Ag+===Cu2++2AgCl↓
【解析】
(1))①根据2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ΔH=-768.2 kJ·mol-1,设为(1)
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) ΔH=+116.0 kJ·mol-1,设为(2)用(1)+(2)
热化学方程式:3Cu2S(s)+3O2(g)=6Cu(s)+6SO2(g)所以Cu2S(s)+O2(g)=2Cu(s)+SO2(g) ΔH=(-768.2+116.0)/3=-217.4 kJ·mol-1,故答案:-217.4
②获得的粗铜需电解精炼,精炼时粗铜作阳极,答案为阳。
(2) ①由方程式:4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4,根据H3PO2变成 H3PO4中P由+1![]() +5化合价变化知该反应还原剂是:H3PO2。
+5化合价变化知该反应还原剂是:H3PO2。
②4CuSO4+3H3PO2+6H2O===4CuH↓+4H2SO4+3H3PO4 转移电子
3 mol 4 mol 12 mol
X 3 mol
X=1mol
该反应每转移3 mol电子,生成CuH的物质的量为1mol
(3)①根据图像可知当c(Cl-)=9 mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为c(CuCl2)>c(CuCl+)>c(CuCl3-)-;
②在c(Cl-)=1 mol·L-1的氯化铜溶液中,滴入AgNO3溶液,由于氯离子易与银离子结合生成氯化银沉淀,则根据图像可知含铜物种间转化的离子方程式可以是CuCl+ + Ag+ =AgCl↓+ Cu2+或CuCl2 + Ag+ = CuCl+ + AgCl↓或CuCl2 + 2Ag+ = Cu2+ + 2AgCl↓。


科目:高中化学 来源: 题型:
【题目】下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A.SO2和SiO2B.CO2和H2O
C.NaCl和HClD.CCl4和NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,下图是镁—次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O===Cl-+Mg(OH)2↓,下列说法不正确的是( )
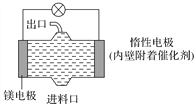
A. 惰性电极上发生氧化反应
B. 镁电极是该电池的负极
C. 正极反应式为ClO-+H2O+2e-===Cl-+2OH-
D. 进料口加入NaClO溶液,出口流出的为NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下进行反应:COCl2(g)![]() Cl2(g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
Cl2(g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法正确的是( )
A. 保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol·L-1,则反应的ΔH<0
B. 若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变
C. 保持其他条件不变,起始向容器中充入1.2 mol COCl2、0.60 mol Cl2和0.60 mol CO,反应达到平衡前的速率:v(正)>v(逆)
D. 保持其他条件不变,起始向容器中充入1.0 mol Cl2和0.8 mol CO,达到平衡时,Cl2的转化率小于60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂醛是重要的医药原料,也是重要的香料,其结构简式如下图所示。
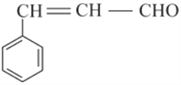
(1)肉桂醛的分子式是_____________________。
(2)肉桂醛所含官能团的名称是___________________、___________________。
(3)肉桂醛与新制Cu(OH)2反应的化学方程式是________________________________。
(4)1 mol肉桂醛与H2完全反应,最多消耗H2的物质的量是________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.含有非金属元素的化合物一定是共价化合物
B.含共价键的化合物一定是共价化合物
C.含有金属元素的化合物可以是共价化合物
D.离子化合物一定含有金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家对一碳化学进行了广泛深人的研究并取得了一些重要成果。
(1)已知:CO(g)+2H2(g) ![]() CH3OH(g) △H1=-90.1kJ/mol;
CH3OH(g) △H1=-90.1kJ/mol;
3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CO与H2合成CH3CH=CH2的热化学方程式为________。
(2)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2mo1H2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。

①5min时三个容器中的反应达到化学平衡状态的是容器_______(填序号)。
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_______。
③当三个容器中的反应均达到平衡状态时,CO的转化率最高的是容器___________。(填序号,下同);平衡常数最小的是容器_____________。
(3)CO常用于工业冶炼金属,在不同温度下用CO 还原四种金属氧化物,达到平衡后气体中![]() 与温度(T)的关系如图2所示。下列说法正确的是_____(填字母)。
与温度(T)的关系如图2所示。下列说法正确的是_____(填字母)。

a.工业上可以通过增高反应装置来延长矿石和CO接触面积,减少尾气中CO的含量
b.CO用于工业冶炼金属铬(Cr)时,还原效率不高
c.工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大
d.CO还原PbO2的反应△H>0
(4)工业废水中含有甲醛,该厂降解甲醛的反应机理如图3所示,则X表示的粒子是_____,总反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
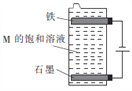
【题目】从下表的阴、阳离子中选出适当的离子组成三种电解质(每种离子只能选用一次),用惰性电极对每种电解质溶液进行电解。回答下列问题:
阳离子 | H+、Na+、Ag+ |
阴离子 | Cl-、SO42-、NO3- |
(1)若阴极放出氢气,阳极放出氧气,且电解后溶液的pH变小,则所选用的电解质的化学式是___________,阴极的电极反应式为___________。
(2)若阴极析出金属,阳极放出氧气,则所选用的电解质的化学式是___________,阳极的电极反应式为_______________________________________________________________。
(3)用如图所示装置电解第三种电解质M的饱和溶液,写出该电解池中发生反应的总化学方程式:____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com