
科目:高中化学 来源: 题型:多选题
| A. | 原子半径:b<c | |
| B. | 最高价氧化物对应水化物的酸性:b>d | |
| C. | 单质沸点:d>c | |
| D. | a、b、c不能存在于同一离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,该反应类型为取代反应.
,该反应类型为取代反应.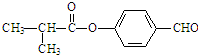 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、MnO4-、Na+、Cl- | B. | Na+、NO3-、H+、SO42- | ||
| C. | K+、NO3-、Na+、CO32- | D. | Na+、HCO3-、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②③⑤ | C. | ③④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | Na2CO3溶液能使酚酞试液变红:CO32-+H2O?HCO3-+OH- | |
| C. | 0.lmol•L-l CH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+ | |
| D. | 向Mg(OH)2悬浊液中加入FeCl3溶液,出现红褐色沉淀:3Mg(OH)2(s)+2Fe3+(aq)═2Fe( OH)3(s)+3Mg2+(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

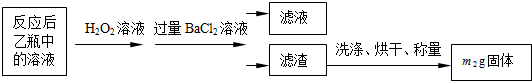
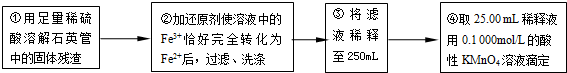
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ Na+ NO3- CO32- | B. | Na十 Fe3+ SCN- SO42- | ||
| C. | K+ Na十 Cl- AlO2- | D. | Al3+ Na+ Cl- SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com