
【题目】在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是( )
A. 0.02 mol/(Lmin)B. 1.2 mol/(Lmin)
C. 1.8mol/(Lmin)D. 0.18 mol/(Lmin)
科目:高中化学 来源: 题型:
【题目】698K时,向VL的密闭容器中充入2molH2(g)和2molI2(g),发生反应:H2(g)+I2(g)![]() 2HI(g) ΔH=-26.5kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
2HI(g) ΔH=-26.5kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
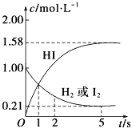
请回答下列问题:
(1)V=______。
(2)该反应达到最大限度的时间是_______,该时间内平均反应速率v(HI)=________。
(3)下列说法中可以说明反应2HI(g)![]() H2(g)+I2(g)已达到平衡状态的是_____。
H2(g)+I2(g)已达到平衡状态的是_____。
A.单位时间内生成nmolH2的同时生成2nmolHI
B.温度和体积一定时,容器内压强不再变化
C.条件一定,混合气体的平均相对分子质量不再变化
D.温度和压强一定时,混合气体的密度不再变化
(4)该反应达到平衡状态时,__________(填“吸收”或“放出”)的热量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氮能与水反应生成硝酸和一氧化氮,关于该反应的说法中正确的是( )
A.二氧化氮是氧化剂,水是还原剂B.二氧化氮是还原剂,水是氧化剂
C.二氧化氮既是氧化剂又是还原剂D.二氧化氮既不是氧化剂又不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)在溶液中会生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是

A. HClO2的电离平衡常数的数值Ka=10-8
B. pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有:c(Na+)+c(OH-)=c(H+)+ c(HClO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用氢气对废气进行脱碳处理可实现绿色环保、废物利用,对于减少雾霾也具有重要意义。
(1)汽车尾气的主要污染物为NO,用H2催化还原NO可以达到消除污染的目的。
已知:2NO(g) ![]() N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
写出H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是______________。
(2)某研究小组模拟研究如下:向2 L恒容密闭容器中充入2 mol NO发生反应2NO(g) ![]() N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:
N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:
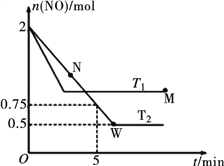
①T2下,在0~5 min内,v(O2)=______________mol·L-1·min-1;该温度下反应N2(g)+O2(g) ![]() 2NO(g)的平衡常数K=______________。
2NO(g)的平衡常数K=______________。
②该反应进行到M点放出的热量______________进行到W点放出的热量(填“>”、“<”或“=”)。
M点时再加入一定量NO,平衡后NO的转化率______________(填“变大”、“变小”或“不变”)。
③反应开始至达到平衡的过程中,容器中下列各项发生变化的是______________(填序号)。
a.混合气体的密度 b.逆反应速率
c.单位时间内,N2和NO的消耗量之比 d.气体的平均相对分子质量
(3)氢气作为一种理想燃料,但不利于贮存和运输。利用氢能需要选择合适的储氢材料,镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g) ![]() LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
A.增加LaNi5H6(s)的量 B.升高温度
C.使用催化剂 D.减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是有机合成的重要还原剂,其合成线路如下图所示。
![]()
(1)铝氢化钠遇水发生剧烈反应,其反应的化学方程式为_____________________。
(2)AlCl3与NaH反应时,需将AlCl3溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因是__________________。
(3)实验室利用下图装置制取无水AlCl3。
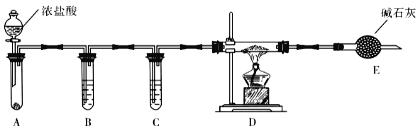
①A中所盛装的试剂是_______________。
②点燃D处酒精灯之前需排除装置中的空气,其操作是______________________。
(4)改变A和D中的试剂就可以用该装置制取NaH,若装置中残留有氧气,制得的NaH中可能含有的杂质为____________
(5)现设计如下四种装置,测定铝氢化钠粗产品(只含有NaH杂质)的纯度。

从简约性、准确性考虑,最适宜的装置是_________(填编号)。称取15.6g样品与水完全反应后,测得气体在标准状况下的体积为22.4L,样品中铝氢化钠的质量分数为___________。(结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )
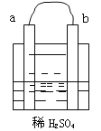
A. 碳棒上有气体放出,溶液的pH增大
B. 导线中有电子流动,电子从a极流到b极
C. a是正极,b是负极
D. a极上发生了氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g) △H = - 574 kJ/mol
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H = - 1160 kJ/mol
③H2O(g) = H2O(l) △H = - 44.0 kJ/mol
写出 CH4(g)与 NO2(g)反应生成 N2(g)、CO2(g)和 H2O(l)的热化学方程式:____________。
(2)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体。4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1,对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填代号)。
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1,对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填代号)。

(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH= a kJ/mol
N2(g)+CO2(g) ΔH= a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
根据图表数据分析T1℃时,该反应在0-20min的平均反应速率
①v(NO)= _________ ;计算该反应的平衡常数K=___________________。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是 ____________(填字母代号)。(双选)
A.通入一定量的CO2 B.加入合适的催化剂 C.适当缩小容器的体积
D.通入一定量的NO E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率_______(填“升高”或“降低”),a _____0(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】八种短周期元素x、y、z、d、e、f、g、h原子序数依次递增,其原子半径、最高正价或最低负价如下表所示。
x | y | z | d | e | f | g | h | |
原子半径/nm | 0.037 | 0.077 | 0.075 | 0.074 | 0.186 | 0.143 | 0.102 | 0.099 |
最高正化合价或最低负化合价 | +1 | +4 | +5 | -2 | +1 | +3 | -2 | -1 |
回答下列问题:
(1)比较d、f常见离子的半径大小(用化学式表示,下同):_______>________;比较g、h的最高价氧化物对应水化物的酸性强弱:________>__________。
(2)由x、d两种元素组成18电子的分子,其电子式为____________,经测定其为二元弱酸,其酸性比碳酸弱,写出其第一步电离的电离方程式____________。
(3)y、d、e组成物质e2yd3的水溶液呈碱性,其原因是____________________(用离子方程式表示),电解该物质e2yd3的溶液,原理如图所示。

其中,离子交换膜使用的是__________(填“阳离子交换膜”或“阴离子交换膜”),阴极产生的物质A的化学式为____________。
(4)f的粉末在1000℃时可与N2反应制备fN。在f的粉末中添加少量NH4Cl固体并充分混合,有利于fN的制备,其主要原因是____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com