
 如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
| ||
| ||


科目:高中化学 来源: 题型:
| A、氨水能导电,所以氨气是电解质 |
| B、SO2的水溶液能导电,但是SO2是非电解质 |
| C、水溶液中NaHSO4=Na++HSO4- |
| D、FeCl3溶液为酸性,因为Fe3++3H2O=Fe(OH)3+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氯化亚铜(Cu2Cl2)是一种重要的化工产品,常用作有机合成催化剂.已知:
氯化亚铜(Cu2Cl2)是一种重要的化工产品,常用作有机合成催化剂.已知:
查看答案和解析>>
科目:高中化学 来源: 题型:

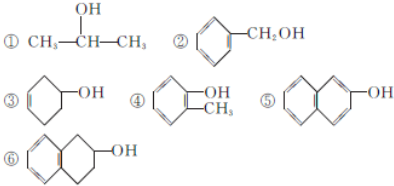
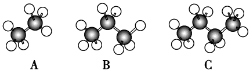
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | 0.01mol?L-1 酸性KMnO4溶液 | 0.1mol?L-1 H2C2O4溶液 | 水 | 1mol?L-1 MnSO4溶液 | 反应温度 /℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | 1mL | 0 | 20 | 320 | ||
| Ⅲ | 0 | 50 | 30 | |||
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 针对化学反应中的能量变化解决下列问题.
针对化学反应中的能量变化解决下列问题.| 1 |
| 2 |
| CuO/CuCl2 |
| 400℃ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-41.2kJ?mol-1 |
| B、+165.0kJ?mol-1 |
| C、-288.6kJ?mol-1 |
| D、+453.6kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
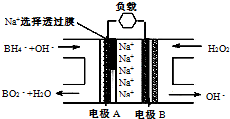 直接NaBH4/H2O2燃料电池(DBFC)的结构如右图,有关该电池的说法正确的是( )
直接NaBH4/H2O2燃料电池(DBFC)的结构如右图,有关该电池的说法正确的是( )| A、电极B材料中包含MnO2层,MnO2可起催化作用 |
| B、电池负极区的电极反应为:BH4-+8OH-+8e-=BO2-+6H2O |
| C、放电过程中,Na+ 从正极区向负极区迁移 |
| D、在电池反应中,每消耗1L 6 mol/LH2O2溶液,理论上流过电路中的电子为6NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将铁锈溶于适量稀硝酸,再滴入KSCN溶液 | 溶液变红 | 该铁锈中只含三价铁 |
| B | 食盐试样中加入盐酸和KI溶液,再加入CCl4振荡 | 下层呈紫红色 | 该食盐试样中可能含有KIO3 |
| C | 某酸雨试样中加入Ba(OH)2溶液 | 有白色沉淀 | 酸雨试样中只含SO42- |
| D | 某卤代烃试样加NaOH溶液煮沸,冷却后用稀硝酸酸化,再加入AgNO3溶液 | 只有白色沉淀 | 该卤代烃为氯代烃 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com