
| A�� | 0.1 mol/L Na2SO3��Һ��c��Na+��=2c��SO32-��+c��HSO3-��+c��H2SO3�� | |
| B�� | 0.1 mol•L-1 NaHCO3��Һ�У�c��Na+����c��HCO3-����c��CO32-����c��H2CO3�� | |
| C�� | �Ե��з�̪��CH3COONa��Һ���м��ȣ���Һ��ɫ����� | |
| D�� | ��pH=5.6��CH3COOH��CH3COONa�Ļ����Һ�У�c��Na+����c��CH3COO-�� |
���� A����������������Һ�е������غ��жϣ�
B��̼��������Һ�У�̼��������ӵĵ���̶�С����ˮ��̶ȣ���Һ��ʾ���ԣ���c��H+����c��OH-����c��H2CO3����c��CO32-����
C����������ӵ�ˮ��Ϊ���ȷ�Ӧ�������¶Ⱥ��������ӵ�ˮ��̶���������Һ������������Ũ����������ǿ��
D��pH=5.6�����ҺΪ���ԣ���c��H+����c��OH-������ϵ���غ��֪��c��Na+����c��CH3COO-����
��� �⣺A.0.1 mol/L Na2SO3��Һ�У����������غ�ɵã�c��Na+��=2c��SO32-��+2c��HSO3-��+2c��H2SO3������A����
B.0.1 mol•L-1 NaHCO3��Һ�У�HCO3-�ĵ���̶�С����ˮ��̶ȣ���Һ��ʾ���ԣ���c��H2CO3����c��CO32-������Һ����ȷ��Ũ�ȴ�СΪ��c��Na+����c��HCO3-����c��H2CO3����c��CO32-������B����
C���Ե��з�̪��CH3COONa��Һ���м��ȣ���������ӵ�ˮ��̶�������Һ������ǿ��������Һ��ɫ������C��ȷ��
D��CH3COOH��CH3COONa�Ļ����Һ��pH=5.6�����ҺΪ���ԣ���c��H+����c��OH-������ϵ���غ��֪��c��Na+����c��CH3COO-������D����
��ѡC��
���� ���⿼��������Ũ�ȴ�С�Ƚϣ���Ŀ�Ѷ��еȣ�ע�������ε�ˮ��ԭ������Ӱ�죬��ȷ����غ㡢�����غ����ж�����Ũ�ȴ�С�е�Ӧ�÷�����������ؿ���ѧ���ķ���������������


 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д� ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��Һ��Ca2+��Ŀ���� | B�� | c��Ca2+������ | ||
| C�� | ��Һ��c��OH-������ | D�� | ��Һ��OH-��Ŀ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
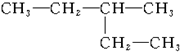 3-������
3-������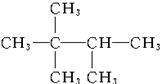 2��2��3-��������
2��2��3-��������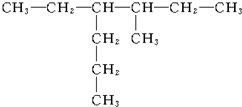 3-��-4-�һ�����
3-��-4-�һ�����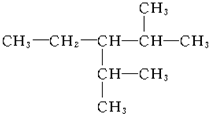 2��5-����-3-�һ�����
2��5-����-3-�һ�����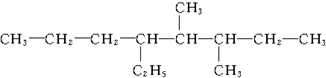 3��4-����-5-�һ�����
3��4-����-5-�һ�����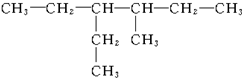 3-��-4-�һ����飮
3-��-4-�һ����飮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  | B�� |  | C�� |  | D�� |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1��1 | B�� | 5��4 | C�� | 4��3 | D�� | 5��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
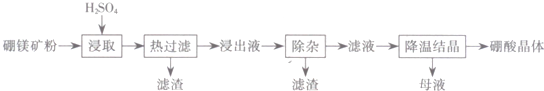
| �¶ȡ棩 | 20 | 40 | 60 | 100 |
| �ܽ�ȣ�g�� | 5.0 | 8.7 | 14.8 | 40.2 |
| ���� | Fe��OH��3 | Al��OH��3 | Fe��OH��2 | Mg��OH��2 |
| pH | 3.2 | 5.2 | 9.7 | 12.4 |
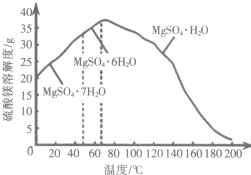
| ��ѧʽ | H2CO3 | CH3COOH |
| ���볣�� | K1=4.4��10-7 K2=4.7��10-11 | K=1.75��10-5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ����� | ��ȡ��Ʒ������/g | ����Ba��OH��2��Һ�����/mL | ������ɳ���������/g |
| 1 | 0.858 | 500 | 1.379 |
| 2 | 1.716 | 500 | |
| 3 | 2.574 | 500 | 4.137 |
| 4 | 3.432 | 500 | 5.516 |
| 5 | 4.290 | 500 | 5.516 |
| 6 | 5.148 | 500 | 5.516 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com