
| A. | 0.5 mol O3的质量为16 g | B. | 32 g O2中含有的氧分子数为2NA | ||
| C. | 1 g H2中含有电子数为1NA | D. | 3.01×1023个铜原子的质量为64 g |
分析 A、根据m=nM计算求解;
B、根据n=$\frac{m}{M}$,N=nNA,计算求解;
C、1 g H2中含有氢原子的物质的量为1mol,含有电子数为1NA;
D、根据n=$\frac{N}{{N}_{A}}$,m=nM计算求解.
解答 解:A、根据m=nM=0.5 mol×48g/mol=24g,故A错误;
B、根据n=$\frac{m}{M}$=$\frac{32g}{32g/mol}$=1mol,氧分子数为N=nNA=1mol×NAmol-=NA,故B错误;
C、1 g H2中含有氢原子的物质的量为1mol,含有电子数为1NA,故C正确;
D、根据n=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$=0.5mol,m=nM=0.5mol×64 g/mol=32g,故D错误;
故选C.
点评 本题考查物质的量的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用以及气体存在的条件,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 化学电池只能将化学能转化为电能 | |
| B. | 金属的电化学腐蚀比化学腐蚀更普遍,金属的析氢腐蚀比吸氧腐蚀更普遍 | |
| C. | 一次电池发生的反应是不可逆的,二次电池发生的反应是可逆反应 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素C与“金施尔康”都是氧化剂 | |
| B. | 维生素C与“金施尔康”都是还原剂 | |
| C. | 维生素C是氧化剂,“金施尔康”是还原剂 | |
| D. | 维生素C是还原剂,“金施尔康”是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
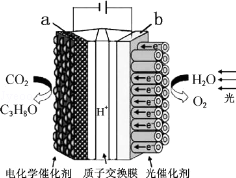 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从a极区向b极区迁移 | |
| C. | 每生成3mol O2,有88gCO2被还原 | |
| D. | a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从试剂瓶中取出的一些Na2CO3溶液放入试管中,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | 稀释浓硫酸时,应将浓硫酸倒入水中,边加边搅拌 | |
| C. | 用蒸发方法使NaCl从溶液里析出,应将蒸发皿中NaCl溶液全部蒸干才停止加热 | |
| D. | 分液操作中,分液漏斗中下层液体从下口放出,上层液体也从下口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2中阴、阳离子的个数比为1:1 | |
| B. | Na202比Na2O稳定,保存时可直接露置于空气中 | |
| C. | Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等 | |
| D. | Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
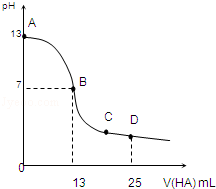 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com