
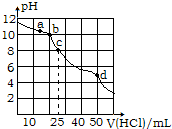
| A. | 该温度下HCO3-的水解常数约为2×10-11 | |
| B. | a点到b点发生的主要离子反应为:HCO3-+H+═H2O+CO2↑ | |
| C. | c点:c(OH-)+c(CO32-)=c(H+)+2c(H2CO3) | |
| D. | d点:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
分析 A.在常温下,用0.1000mol•L-1的盐酸滴定25mL 0.1000mol•L-1Na2CO3溶液,滴定到25ml时发生反应HCO3-+H2O?H2CO3+OH-,此时PH=8,结合平衡常数计算;
B.b点时n(HCl)=0.1mol/L×0.02L=0.002mol,n(Na2CO3)=0.1000mol/L×0.0250L=0.0025mol,反应后得到NaHCO3物质的量为0.002mol,Na2CO3物质的量为0.0005mol,b点生成碳酸氢钠和碳酸钠溶液;
C.c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成NaHCO3,结合溶液中电荷守恒和物料守恒计算分析;
D.d点时加入盐酸0.005mol,溶液中溶由反应生成的CO2,溶液存在电荷守恒,从电荷守恒的角度分析.
解答 解:A.在常温下,用0.1000mol•L-1的盐酸滴定25mL 0.1000mol•L-1Na2CO3溶液,滴定到25ml时发生反应HCO3-+H2O?H2CO3+OH-,此时PH=8,c(OH-)=c(H2CO3)=10-6mol/L,c(HCO3-)=$\frac{0.1000mol/L×0.0250L}{0.050L}$=0.05mol/L,K=$\frac{c(O{H}^{-})c({H}_{2}C{O}_{3})}{c(HC{{O}_{3}}^{-})}$=$\frac{1{0}^{-6}×1{0}^{-6}}{0.05}$=2.0×10-11,故A正确;
B.b点时n(HCl)=0.1mol/L×0.02L=0.002mol,n(Na2CO3)=0.1000mol/L×0.0250L=0.0025mol,反应后得到NaHCO3物质的量为0.002mol,Na2CO3物质的量为0.0005mol,a点到b点发生的主要离子反应为CO32-+H+=HCO3-,故B错误;
C.c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成NaHCO3,溶液中存在电荷守恒和物料守恒,c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),c(OH-)+c(CO32-)=c(H+)+c(H2CO3),故C错误;
D.d点时加入盐酸0.005mol,溶液中溶由反应生成的CO2,溶液存在电荷守恒,存在c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)+c(Cl-),由于c(Na+)=c(Cl-),则 c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故D错误;
故选A.
点评 本题综合考查离子浓度的大小比较,题目难度较大,本题注意分析反应物的物质的量之间的关系,判断反应的程度以及溶液的主要成分,结合盐类水解的原理解答.


科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
下列各组中的两种物质作用时,反应条件(温度?反应物用量比)改变,不会引起产物的种类改变的是( )
A.Na和O2 B.NaOH和CO2
C.Na2O2和CO2 D.NaHCO3和Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 离子 | Cu2- | Al3+ | H+ | Cl- | SO42- |
| c(mol/L) | 1 | 1 | 2 | 3 | a |
| A. | 电路中共转移0.9mol电子 | B. | 铝元素以Al(OH)3的形式存在 | ||
| C. | 阴极质量增加3.2g | D. | a=2 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
将15mL 2mol/LNa2CO3溶液逐滴加入到40mL 1.5mol/LMCln盐溶液中,恰好将溶液中的Mn+完全沉淀为碳酸盐,则MCln中n值是()
A.4 B.3 C.2 D.l
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子 | 要求 |
| A | K+、Cl-、SO42-、MnO4- | c(K+)<c(Cl-) |
| B | Na+、Ca2+、I-、NO3- | c(H+)/c(OH-)=1×1014 |
| C | Al3+、NH4+、SO42-、CH3COO- | 滴加NaOH溶液立刻有气体产生 |
| D | Na+、Mg2+、Ag+、NO3- | 滴加氨水先有沉淀产生,后沉淀部分溶解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
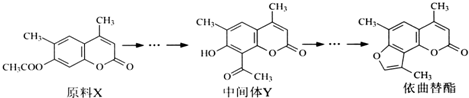
| A. | X与Y互为同分异构体 | |
| B. | 可用酸性KMnO4溶液鉴别X和Y | |
| C. | 1molY能与6molH2或3mol NaOH发生反应 | |
| D. | 依曲替酯只能发生加成、取代、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 | |
| B. | Y元素最高价氧化物对应的水化物化学式为H2YO4 | |
| C. | 原子半径由大到小的顺序为Z>Y>W | |
| D. | X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向AgCl悬浊液中加入NaI溶液 | 出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
| C | 向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| D | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com