
【题目】能够用于鉴别SO2和CO2两种无色气体的溶液是
A. 酸性KMnO4溶液 B. BaCl2溶液
C. 紫色石蕊试液 D. 澄清石灰水
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。 回答下列问题:

(1)外电路的电流方向是由________极流向________极(填字母)。
(2)电池正极反应式为___________________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),原因是________________________________________________________________。
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为_______________________________________________。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式表达正确的是
A. 用惰性电极电解氯化镁溶液:2Cl+2H2O ![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B. 将氯化亚铁溶液和稀硝酸混合:3Fe2++NO3 -+4H+=3Fe3++NO↑+2H2O
C. 碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++ OH-====NH3·H2O
D. NaAlO2 溶液中通入过量 CO2:2AlO2-+ CO2 + 3H2O === 2Al(OH)3↓ +CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某同学设计了如下实验流程:在一个小烧杯里,加入20g Ba(OH)2·8H2O晶体和10gNH4Cl晶体,然后将小烧杯放在事先已滴有3滴~4滴水的玻璃片上,并立即用玻璃棒迅速搅拌。实验流程示意图如下,回答下列问题:
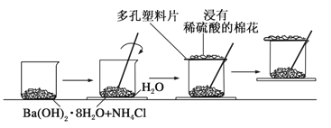
①实验中玻璃棒的作用是_______。
②浸有稀硫酸的棉花的作用是______。
(2)沼气是一种廉价能源,农村存在大量的秸秆、杂草等废弃物,它们经微生物发酵之后,便可产生沼气,可用来点火做饭。在农村推广建造沼气池,不仅能有效地利用____能,还能为农业生产提供优良的肥料。已知:标准状况下的112.0LCH4气体完全燃烧,生成CO2和液态水,放出4448kJ的热量。
①写出CH4完全燃烧的热化学方程式为________。
②如果上述反应生成的是水蒸气,则反应放出的热量___4448kJ。(填“>”或“<”或“=”)
(3)钢铁在潮湿的空气中生锈主要是由电化学腐蚀造成的,发生腐蚀时铁和内部的杂质碳及钢铁表面的电解质溶液形成原电池。钢铁发生吸氧腐蚀时正极的电极反应式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库。
Ⅰ.从海水中提取食盐和溴![]() 海水中溴以溴化钠为主
海水中溴以溴化钠为主![]() 的过程如下:
的过程如下:
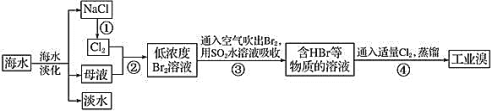
(1)工业上是利用步骤①所得的NaCl固体制备金属钠的化学方程式为:______。
(2)步骤②的离子方程式为:________。
(3)步骤③用![]() 水溶液吸收
水溶液吸收![]() ,可制得两种强酸,化学方程式为:_____。
,可制得两种强酸,化学方程式为:_____。
Ⅱ.海洋植物如海带、海藻中含有丰富的碘元素,燃烧的灰烬中碘元素以![]() 的形式存在。实验室里从海藻中提取碘的流程如下:
的形式存在。实验室里从海藻中提取碘的流程如下:
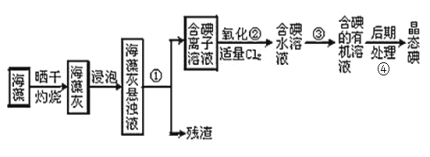
(4)指出提取碘的过程中有关的实验操作名称:
①_____③_____④______
(5)提取碘的过程中,可供选择的有机试剂是_____(填字母)。
A.苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,发生可逆反应mA(g) + nB(g) ![]() pC(g) + qD(g),当m、n、p、q为任意整数时,反应达到平衡的标志是( )
pC(g) + qD(g),当m、n、p、q为任意整数时,反应达到平衡的标志是( )
②体系温度不再改变
③各组分的浓度不再改变
④各组分的质量分数不再改变
⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
⑥单位时间内m mol A断键反应,同时p mol C也断键反应
⑦体系的密度不再变化
A.③④⑤⑥ B.②③④⑥
C.①③④⑤ D.③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1)1 mol C2H4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出1411 kJ能量: 。
(2)1 mol C2H5OH(l)与适量O2(g)反应生成CO2(g)和H2O(l),放出1366.8 kJ热量: 。
(3)2 mol Al(s)与适量O2(g)发生反应生成Al2O3(s),放出1669.8 kJ热量: 。
(4)在200°C、101 kPa时,1 mol H2与碘蒸气作用生成HI气体,放出14.9 kJ热量: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com