
【题目】IBr、ICl等称之为卤素互化物,![]() 、
、![]() 、
、![]() 等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
![]() 氯化碘
氯化碘![]() 能与水发生反应:
能与水发生反应:![]() ,该反应_______
,该反应_______![]() 填“是”或“不是”
填“是”或“不是”![]() 氧化还原反应。
氧化还原反应。
![]() 溴化碘
溴化碘![]() 具有强氧化性,能与
具有强氧化性,能与![]() 溶液发生反应,发生反应的离子方程式为___。
溶液发生反应,发生反应的离子方程式为___。
![]() 已知某些离子的还原性强弱顺序为
已知某些离子的还原性强弱顺序为![]() 。现将几滴KSCN溶液滴入到含少量
。现将几滴KSCN溶液滴入到含少量![]() 的溶液中,溶液立即变红,向其中逐滴滴入酸性
的溶液中,溶液立即变红,向其中逐滴滴入酸性![]() 溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象_______________。
溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象_______________。
![]() 下列物质中,也可以使该溶液红色褪去的是 _________。
下列物质中,也可以使该溶液红色褪去的是 _________。
A.新制氯水 ![]() 碘水
碘水 ![]()
![]() 盐酸
盐酸
![]() 为剧毒物质,处理含有KCN的废水常用的方法是:在碱性条件下用NaClO溶液将
为剧毒物质,处理含有KCN的废水常用的方法是:在碱性条件下用NaClO溶液将![]() 氧化为
氧化为![]() 和一种单质气体,该反应的离子方程式为_______________。
和一种单质气体,该反应的离子方程式为_______________。
【答案】![]()
![]() 酸性高锰酸钾将
酸性高锰酸钾将![]() 氧化,减小了
氧化,减小了![]() 的浓度,使
的浓度,使![]() ,平衡不断向左移动,最终
,平衡不断向左移动,最终![]() 完全反应,红色消失
完全反应,红色消失 ![]()
![]()
【解析】
(1)反应中各元素化合价不变,不是氧化还原反应;
![]() 溴化碘
溴化碘![]() 具有强氧化性,能与
具有强氧化性,能与![]() 溶液反应,反应中IBr被还原,亚硫酸钠被氧化;
溶液反应,反应中IBr被还原,亚硫酸钠被氧化;
![]() 根据平衡移动原理分析;
根据平衡移动原理分析;
![]() 能与
能与![]() 或
或![]() 反应的离子可使溶液褪色,其中氯水与
反应的离子可使溶液褪色,其中氯水与![]() 反应,二氧化硫与铁离子反应;
反应,二氧化硫与铁离子反应;
![]() 碱性条件下
碱性条件下![]() 与NaClO反应生成
与NaClO反应生成![]() 、
、![]() 和
和![]() 。
。
![]() 为复分解反应,不是氧化还原反应,
为复分解反应,不是氧化还原反应,
故答案为:不是;
![]() 溴化碘
溴化碘![]() 具有强氧化性,能与
具有强氧化性,能与![]() 溶液反应,反应中IBr被还原,亚硫酸钠被氧化,反应的离子方程式为
溶液反应,反应中IBr被还原,亚硫酸钠被氧化,反应的离子方程式为![]() ,
,
故答案为:![]() ;
;
![]() 溶液中存在
溶液中存在![]() ,高锰酸钾具有强氧化性,可氧化
,高锰酸钾具有强氧化性,可氧化![]() ,则酸性高锰酸钾将
,则酸性高锰酸钾将![]() 氧化,减小了
氧化,减小了![]() 的浓度,使
的浓度,使![]() ,平衡不断向左移动,最终
,平衡不断向左移动,最终![]() 完全反应,红色消失
完全反应,红色消失
故答案为:酸性高锰酸钾将![]() 氧化,减小了
氧化,减小了![]() 的浓度,使
的浓度,使![]() ,平衡不断向左移动,最终
,平衡不断向左移动,最终![]() 完全反应,红色消失;
完全反应,红色消失;
![]() 能与
能与![]() 或
或![]() 反应的离子可使溶液褪色,其中氯水与
反应的离子可使溶液褪色,其中氯水与![]() 反应,二氧化硫与铁离子反应,
反应,二氧化硫与铁离子反应,
故答案为:AC;
![]() 碱性条件下
碱性条件下![]() 与NaClO反应生成
与NaClO反应生成![]() 、
、![]() 和
和![]() ,反应的离子方程式为
,反应的离子方程式为![]() ,
,
故答案为:![]() 。
。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】已知可逆反应2SO2+O2![]() 2SO3是放热反应,下列说法正确的是( )
2SO3是放热反应,下列说法正确的是( )
A.2 molSO2与1molO2能完全反应生成2 mol SO3,升高温度可以加快此反应的化学反应速率
B.2molSO2与1molO2不能完全反应生成2molSO3,升高温度可以加快此反应的化学反应速率
C.2mol SO2与1 molO2能完全反应生成2molSO3,升高温度减慢此反应的化学反应速率
D.2molSO2与1molO2不能完全反应生成2molSO3,升高温度减慢此反应的化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O![]() Fe2O3+ SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是
Fe2O3+ SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是
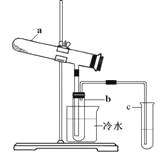
A.若将反应后的三种气体通入BaCl2溶液中,产生的沉淀为BaSO3、BaSO4
B.b中产物用紫色石蕊试液即可检验出其中H+和SO42—
C.为检验反应的另一种生成物,试管c中应加入的试剂为NaOH溶液
D.b中所得到的硫酸的质量分数为29.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用O2将HCl转化为Cl2,可提高效益,减少污染,
(1)传统上该转化通过如图所示的催化剂循环实现,
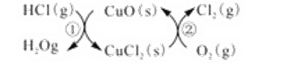
其中,反应①为:2HCl(g) + CuO(s)![]() H2O(g)+CuCl2(g) △H1
H2O(g)+CuCl2(g) △H1
反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为___________(反应热用△H1和△H2表示)。
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的aHCl—T曲线如图,则总反应的△H___0(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是_______。
②在上述实验中若压缩体积使压强增大,画出相应aHCl—T曲线的示意图,并简要说明理由______________。
③下列措施中有利于提高aHCl的有___________。
A、增大n(HCl) B、增大n(O2)
C、使用更好的催化剂 D、移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率______(以mol·min-1为单位,写出计算过程)。
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
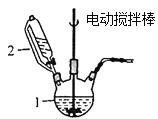
【题目】CuCl用于石油工业脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。实验室用CuSO4-NaCl混合液与Na2SO3溶液反应制取CuCl。
回答以下问题:
(1)图中仪器1的名称是________;制备过程中Na2SO3过量会发生副反应生成[Cu(SO3)2]3-,为提高产率,仪器2中所加试剂应为_________(填“A”或“B”)。
A.CuSO4-NaCl混合液 B.Na2SO3溶液
(2)如图是体系pH随时间变化关系图:
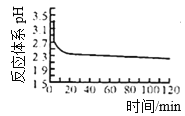
写出制备CuCl的离子方程式_______________;
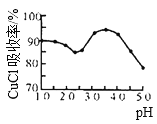
(3)如图是产率随pH变化关系图,实验过程中往往用CuSO4- Na2CO3混合溶液代替Na2SO3溶液,其中Na2CO3的作用是__________________并维持pH在____________左右以保证较高产率。
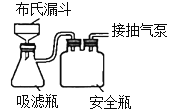
(4)反应完成后经抽滤、洗涤、干燥获得产品。抽滤所采用装置如图所示,其中抽气泵的作用是使吸滤瓶与安全瓶中的压强减小,跟常规过滤相比,采用抽滤的优点是_________________(写一条);洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CaSO4代替O2与燃料CO反应是一种高效、清洁的新型燃烧技术,发生如下反应:
①![]() CaSO4(s)+CO(g)
CaSO4(s)+CO(g) ![]() CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1
CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1
②CaSO4(s)+CO(g) CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
③CO(g) ![]() C(s)+
C(s)+![]() CO2(g) ΔH3=-86.2 kJ·mol-1
CO2(g) ΔH3=-86.2 kJ·mol-1
下列说法错误的是 ( )
A. 反应①达到平衡时,增大压强平衡不移动
B. 反应②的平衡常数表达式为K=![]()
C. 反应①和②是主反应,反应③是副反应
D. 2CaSO4(s)+7CO(g) ![]() CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)是放热反应
CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述错误的是![]()
化学方程式 | 平衡常数K |
|
|
|
|
|
|
|
|
A.已知1molCO燃烧放出的热为283kJ,![]() ;
;![]() 则
则 表示CO和
表示CO和![]() 生成
生成![]() 和
和![]() 的能量变化
的能量变化
B.常温下![]()
![]() HB溶液和
HB溶液和![]()
![]() 溶液等体积混合后溶液的
溶液等体积混合后溶液的![]() ,则混合溶液中离子浓度的大小顺序为:
,则混合溶液中离子浓度的大小顺序为:![]()
C.常温下,![]() 和
和![]() 反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时
反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时![]() 从
从![]() 到
到![]() 的转化率逐减小,且HX的还原性逐渐减弱
的转化率逐减小,且HX的还原性逐渐减弱
D.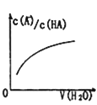 中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中, 的变化情况
的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是( )
A.3 g 3He含有的中子数为1NA
B.1 L 0.1 mol·L1磷酸钠溶液含有的![]() 数目为0.1NA
数目为0.1NA
C.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D.常温下,11g CO2所含的共用电子对数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com