
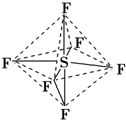
| A. | 六氟化硫中各原子均为8电子稳定结构 | |
| B. | 六氟化硫易燃烧生成二氧化硫 | |
| C. | 六氟化硫分子中含极性键、非极性键 | |
| D. | S-F键是σ键,且键长、键能都相等 |
分析 A.根据图片知,每个F原子和S原子形成一对共用电子对,每个S原子和六个F原子形成六对共用电子对;
B.SF6中F为-1价,则S为+6价,S元素不能再失电子,所以不能被氧化;
C.共价键极性的判断,同种原子间形成非极性键,不同原子间形成极性键;
D.六氟化硫分子中的S-F键都是σ键,为正八面体结构,键长、键能都相等.
解答 解:A.根据图片知,每个F原子和S原子形成一对共用电子对,每个S原子和六个F原子形成六对共用电子对,所以F原子都达到8电子稳定结构,但S原子最外层达到12电子,故A错误;
B.SF6中F为-1价,则S为+6价,S元素不能再失电子,所以不能被氧化,则六氟化硫不易燃烧生成二氧化硫,故B错误;
C.共价键极性的判断,同种原子间形成非极性键,不同原子间形成极性键,六氟化硫分子中的S-F键均为极性键,不含非极性键,故C错误;
D.六氟化硫分子中的S-F键都是σ键,为正八面体结构,所以键长、键能都相等,故D正确;
故选D.
点评 本题考查共价键极性判断、8电子稳定结构判断、物质性质等知识点,为高考高频点,侧重考查学生观察、获取信息、运用信息能力,易错选项是A,很多同学往往认为含有硫元素就能燃烧而导致错误判断.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热为△H=-110.5 kJ/mol | |
| B. | 1molC(s)所具有的能量一定高于1molCO(g)所具有的能量 | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热为△H=-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,也放出57.3 kJ 热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 假设 | 推断 | |
| A | 若X、Y均能发生消去反应 | Z一定能发生消去反应 |
| B | 若X是白酒的主要成分 | Y可能是丙三醇 |
| C | 若X、Y分子中分别有1个、2个碳原子 | Z的摩尔质量不小于60 g•mol-1 |
| D | 若X、Y均存在醇类同分异构体 | Z一定存在醇类同分异构体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+H2→CH3-CH3 | B. | CH2=CH2+3O2→2CO2+2H2O | ||
| C. | CH2=CH2+Br2→CH2Br-CH2Br | D. | CH2=CH2+H2O$\frac{\underline{\;催化剂\;}}{\;}$CH3CH2OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com