
NA为阿伏加德罗常数,下列叙述正确的是
A、标准状况下,含NA个氩原子的氩气的体积约为11.2 L
B、31g白磷分子中,含有的共价单键数目是NA个
C、 6 g金刚石晶体中含有的碳碳键数目为2×6.02×1023
D、4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023
【答案】D
【解析】
试题分析:A、氩是单原子分子,在标准状况下,含NA个氩原子的氩气的体积约为22.4 L.错误。B、白磷P4相对分子质量为124.每摩尔的白磷中含有P-P键6mol.则31g白磷分子中,含有的白磷分子的物质的量为0.25mol.所以其中含有的共价单键数目是0.25mol×6=1.5mol.个数为1.5NA个.错误。C、 在金刚石晶体中,每1mol的C与相邻的4mol的C形成共价键。每个共价键为两个原子所共有。所以每含有1mol的C原子,则含有2mol的共价键。现在有6 g金刚石晶体,所以其中中含有的碳碳键数目为6.02×1023。错误。D、n(SiO2)=4.5g ÷60g/mol=0.075mol.每1mol的 SiO2晶体中含有的硅氧键为4mol,所以0.075mol晶体中的Si—O共价键数目为0.3×6.02×1023。正确。
考点:考查阿伏加德罗常数的有关计算的知识。


科目:高中化学 来源: 题型:
1)、不必试写,判断一氯丁烷(C4H9Cl)的同分异构体有_____种
2)、乙烯和丙烯按物质的量之比为1∶1聚合时,可生成聚合物乙丙树脂,该聚合物的结
构简式可能是_____________________、_______________________。
3)、某不饱和烃与氢气加成后的生成物为
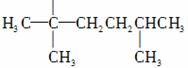 H
H
请按要求回答下列问题:
①请用系统命名法对该物质进行命名:________________________________________。
②若某不饱和烃为单烯烃,则可能有________种结构。其中一种与H2O加成产物只有一种,则此单烯烃的结构式为__________________。
4)、CH2=CHCH3加聚反应的化学程式____________________________________。
5)、某烃含碳的质量分数为6/7,在标准状况下,11.2 L此气态化合物的质量为28 g,则该化合物的同分异构体有 _____种
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y和Z均为短周 期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最外层电子数相同。回答下列问题:
期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最外层电子数相同。回答下列问题:
(1)X、Y和Z的元素符号分别为__________、__________、__________。
(2)由上述元素组成的化合物中,既含有共价键又含有离子键的有__________、__________。
(3)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是____________。此化合物在酸性条件下与高锰酸钾反应的离子方程式为________________________;此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各基态原子或离子的电子排布式正确的是
A、O2- 1s22s22p4 B、Ca [Ar]3d2
C、Fe [Ar]3d54s3 D、Si 1s22s22p63s23p2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列判断正确的是
A、根据同周期元素的第一电离能变化趋势,推出P的第一电离能比S大
B、根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正化合价都是+7
C、晶体中一定存在化学键
D、正四面体分子中键角只能是109°28′
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,请回答下列问题
(1)基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(2)在BF3分子中,F-B-F的键角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为_______;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似, 硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z均为元素周期表中的前20号元素,且可形成化合物XYZ4;三种元素原子序数之和为44,且均不在同一周期,但Y和Z同主族,下列有关推断中正确的是( )
A.XYZ4是一种可溶于水的盐,且X与Y可形成离子化合物XY
B.XYZ4是一种微溶于水的盐,且X与Y可形成离子化合物XY
C.XYZ4是一种易溶于水的盐,且Y与Z可形成共价化合物YZ
D.XYZ4是一种离子化合物,且Y与Z可形成离子化合物YZ2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是( )
A.用新制的银氨溶液可区分甲酸甲酯和乙醛
B.用高锰酸钾酸性溶液可区分己烷和3-己烯
C.用水可区分苯和溴苯
D.用金属钠可区分乙醇和乙醚
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com