
 草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:
草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:
| 实验组别 | c(H2C2O4) /(mol/L) | V(H2C2O4) /ml | c(KMnO4) /(mol/L) | V(KMnO4) /ml | c(H2SO4) /(mol/L) | 褪色所需时间 | 实验 目的 |
| 1 | 0.2 | 2 | 0.0025 | 4 | 0.12 | 6′55″ | (a)探究KMnO4溶液浓度对化学反应速率的影响 |
| 0.2 | 2 | 0.005 | 4 | 0.12 | 5′17″ | ||
| 0.2 | 2 | 0.01 | 4 | 0.12 | 3′20″ | ||
| 0.2 | 2 | 0.02 | 4 | 0.12 | 9′05″ | ||
| 0.2 | 2 | 0.03 | 4 | 0.12 | 11′33″ | ||
| 0.2 | 2 | 0.04 | 4 | 0.12 | 14′20″ |
分析 (一)①草酸与氢氧化钙反应生成醋酸钙沉淀,干扰二氧化碳的检验,所以A中的乙醇目的是除去草酸,则B中的试剂是Ca(OH)2或Ba(OH)2溶液,目的是检验二氧化碳的存在;
②草酸能够与检验二氧化碳的氢氧化钡或氢氧化钙反应生成沉淀,干扰二氧化碳的检验,用乙醇的目的是除去草酸;
(二)草酸为二元弱酸,二者恰好反应生成草酸钠,草酸根离子部分水解,溶液显示碱性;
(三)I.①高锰酸根离子中Mn元素的化合价从+7价降低到+2价,得到5个电子,草酸中C元素的化合价从+3价升高到+4价,共失去2个电子,根据得失电子守恒配平该反应;
②高锰酸钾的氧化性强,易腐蚀碱式滴定管的胶管,应该选用酸式滴定管盛放高锰酸钾;
II.(1)当分析某一因素对化学反应速率的影响时,其它物理量要相同,该组除了KMnO4溶液浓度不同以外,其它条件完全相同;
(2)根据表中数据描点作图,注意关键点;
(3)选择MnSO4而不选MnCl2作为催化剂,是因为能发生2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O.
解答 解:(一)①草酸混合气体中含有未分解的草酸,草酸与氢氧化钙反应生成醋酸钙沉淀,干扰二氧化碳的检验,所以A中的乙醇目的是除去草酸,则B中的试剂是Ca(OH)2或Ba(OH)2溶液,目的是检验二氧化碳的存在,C中氢氧化钠的作用是除去二氧化碳,以便检验CO的存在,
故答案为:Ca(OH)2或Ba(OH)2;
②草酸能够与检验二氧化碳的氢氧化钡或氢氧化钙反应生成沉淀,会影响二氧化碳的测定,故A中乙醇的目的是除去H2C2O4,避免对CO2的检验造成干扰,
故答案为:除去H2C2O4,避免对CO2的检验造成干扰;
(二)草酸是二元酸,与氢氧化钠反应时二者恰好完全反应,若草酸是强酸,则反应后的溶液为中性,现在溶液呈碱性,说明草酸为弱酸,草酸根离子水解,使溶液呈碱性,离子方程式为:C2O42-+H2O?HC2O4-+OH-,
故答案为:C2O42-+H2O?HC2O4-+OH-;
(三)I.①高锰酸根离子中Mn元素的化合价从+7价降低到+2价,得到5个电子,草酸中C元素的化合价从+3价升高到+4价,共失去2个电子,根据得失电子守恒,则高锰酸根离子的系数是2,草酸的系数是5,根据元素守恒配平Mn2+、CO2的系数,最后根据电荷守恒配平氢离子、水的系数,配平后的反应为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2;5; 6H+;2;10;8;
②高锰酸钾的氧化性强,所以不能用碱式滴定管,易腐蚀碱式滴定管的胶管,所以用酸式滴定管盛放高锰酸钾,
故答案为:酸式;
II.(1)由表中数据可知,草酸的浓度、体积都不变,稀硫酸的浓度不变,KMnO4浓度变化,该组除了KMnO4溶液浓度不同以外,其它条件完全相同,所以探究KMnO4溶液浓度不同对化学反应速率影响,
故答案为:探究KMnO4溶液浓度对化学反应速率的影响;
(2)根据表中的褪色时间可作图,如c(KMnO4)=0.0025mol/L,褪色所需时间6′55″,描点,依此类推,可得图: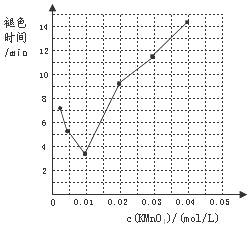 ,
,
故答案为: ;
;
(3)若要探究催化剂对该反应速率的影响选择,选择硫酸锰,而不选氯化锰,是因为在酸性条件下,高锰酸根离子能将氯离子氧化成氯气,自身被还原成二价锰离子,反应方程式为2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O,
故答案为:氯离子可与酸性高锰酸钾发生氧化还原反应.
点评 本题考查对草酸性质的探究实验的设计与评价、化学方程式的配平及气体的检验,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力,明确实验目的及常见物质的性质及检验方法为解答关键,注意掌握性质实验方案设计与评价原则.


科目:高中化学 来源: 题型:选择题
| A. | W一定是氢元素 | |
| B. | 简单离子半径rz>rx>ry | |
| C. | 标准状况下,1mol Z的最高价氧化物的体积约为22.4L | |
| D. | 工业上常用电解熔融Y的氯化物的方法制备Y单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 重大节日期间燃放的焰火的颜色是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 小苏打是制作馒头和面包等糕点的膨松剂,也是治疗胃酸过多的一种药剂 | |
| C. | 为防止月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| D. | 大力实施矿物燃料的脱硫脱硝技术,可以减少SO2、NO2的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有还原性,可用于漂白纸浆 | |
| B. | 碳酸氢钠能与碱反应,可用作食品的膨松剂 | |
| C. | 四氯化碳密度比水大,可用于萃取溴水中的Br2 | |
| D. | MgO、Al2O3的熔点都很高,都可用作耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
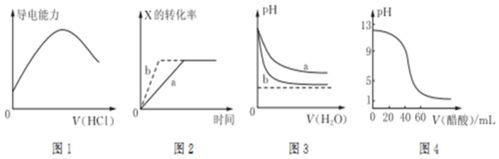
| A. | 图1表示向氨水中通入HC1气体,溶液的导电能力变化 | |
| B. | 图2所示反应:X(g)+2Y(g)?3Z(g),b曲线表示的一定是增大压强 | |
| C. | 图3可表示pH相同的NaOH溶液与氨水稀释过程的pH变化,其中曲线a对应氨水 | |
| D. | 图4可表示用0.100 0 mol/L,醋酸滴定40.00 mL 0.100 0 mol/L NaOH溶液得到的滴定曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 硅原子最外层有4个电子 | |
| B. | 太阳能电池是一种化学电源 | |
| C. | 太阳能电池实现了光能向电能的转化 | |
| D. | B电极为电源正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的醋酸与pH=11的氢氧化钾 | B. | 0.1mol/L的盐酸与0.1mol/L的氨水 | ||
| C. | 0.001mol/L的盐酸与pH=11的氨水 | D. | pH=3的盐酸与0.001mol/L的氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某科研单位利用电化学原理用SO2来制备硫酸,装置如图,含有某种催
某科研单位利用电化学原理用SO2来制备硫酸,装置如图,含有某种催查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com