
��ҵ���Ը�����(��Ҫ�ɷ�ΪFeO��Cr2O3)��̼���ơ�����������Ϊԭ�������ظ�����(Na2Cr2O7��2H2O)������Ҫ��Ӧ���£�
��4FeO��Cr2O3��8Na2CO3��7O2 8Na2CrO4��2Fe2O3��8CO2
8Na2CrO4��2Fe2O3��8CO2
��2Na2CrO4��H2SO4??Na2SO4��Na2Cr2O7��H2O
����˵����ȷ����(����)
| A����Ӧ�ٺ͢ھ�Ϊ������ԭ��Ӧ |
| B����Ӧ�ٵ���������O2����ԭ����FeO��Cr2O3 |
| C��Na2Cr2O7��CrԪ�صĻ��ϼ�Ϊ��7 |
| D����Ӧ��������1 mol��Na2CrO4ʱ��ת��28 mol���� |
 ���Ǽ���С����ϵ�д�
���Ǽ���С����ϵ�д� �Ͻ�ƽ���Ȿϵ�д�
�Ͻ�ƽ���Ȿϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������ԭ��Ӧ�����ֻ������ͷ�Ӧ�Ĺ�ϵ����ͼ��ʾ�������л�ѧ��Ӧ����4�����ǣ� ����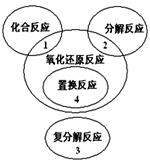
| A��Cl2+2KBr=Br2+2KCl |
| B��2NaHCO3=Na2CO3+H2O+CO2 |
| C��4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D��2Na2O2+2CO2=2Na2CO3+O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
Һ̬�����������¼����������������о綾�� ʵ����Ϊ�������й������ĺ�����ͨ��������CuI����ֽ��������ֽ�Ƿ��ɫ����ɫ�����仯��ʱ�����жϿ����й��ĺ������䷴ӦΪ��
4CuI��Hg�� Cu2HgI4��2Cu��I�Ļ��ϼ۷�Ӧǰ���Ϊ��1�۵ģ��������й�˵������ȷ����(�� )
| A��������Ӧ�IJ���Cu2HgI4�У�Hg�Ļ��ϼ�Ϊ��2 |
| B��������Ӧ����������CuI |
| C��������Ӧ��CuԪ�ؽ���һ�뱻��ԭ |
| D��������Ӧ������64gCuʱ��ת�Ƶĵ�����Ϊ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�谱��������һ����Ҫ�Ļ���ԭ�ϣ����Ʊ��Ļ�ѧ����ʽΪ��CaCO3+2HCN = CaCN2+CO��+H2��+CO2��������˵����ȷ����
| A��COΪ�������H2Ϊ��ԭ���� | B��CaCN2�к��зǼ��Լ� |
| C��HCN�������������ǻ�ԭ�� | D��ÿ����10g CaCO3����2.24L CO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ij��Һ�к��е�������FeBr2��FeI2�����������Һ��ͨ��һ����������������Ӧ�����Һ�еμ�KSCN��Һ����Һ��Ϊ��ɫ��������������ȷ���� (����)��
��ԭ��Һ�е�Br��һ������������ͨ������֮��ԭ��Һ�е�Fe2��һ���в��ֻ�ȫ�����������۲���ȷ��ͨ�����������Һ���Ƿ����Fe2��������ȡ����������Һ���ټ���CCl4�����á���Һ�����ϲ���Һ�м���������AgNO3��Һ��ֻ������ɫ������˵��ԭ��Һ�е�I����Fe2����Br��������ȫ������
| A���٢ڢ� | B���ڢۢ� | C���٢ۢ� | D���٢ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��100 mL 18 mol/L�������м�������ͭƬ,���Ȳ���ַ�Ӧ�������й�˵����ȷ����(����)
| A����ַ�Ӧ��ת��1.8 mol���� |
| B��H2SO4ֻ�������� |
| C����������Ӧ����H2 |
| D�����ĵ�ͭ������һ������57.6 g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ������Fe��FeO��Fe2O3�Ļ�����м���120 mL 4 mol��L��1��ϡ���ᣬǡ��ʹ�������ȫ�ܽ⣬�ų�1.344 L NO(��״��)����������Һ�м���KSCN��Һ����ɫ���֡����������������ڼ����»�ԭ��ͬ�����Ļ����ܵõ��������ʵ���Ϊ�� ��
| A��0.24 mol | B��0.16 mol | C��0.21 mol | D��0.14 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������KOH��,�����е����ɽ�������FeCr2O4����Fe��Cr�Ļ��ϼ۶�ת��Ϊ+6��,����1 mol FeCr2O4����������Ҫ������ ��
| A��2 mol | B��2.5 mol | C��3 mol | D��4 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
24 mLŨ��Ϊ0.05 mol��L��1��Na2SO3��Һ����֪��Ԫ�����Ϊ��6�ۣ���ǡ����20 mLŨ��Ϊ0.02 mol��L��1��K2Cr2O7��CrԪ�����Ϊ��6�ۣ���Һ��ȫ��Ӧ����Ԫ��Cr�ڱ���ԭ�IJ����еĻ��ϼ��ǣ���������
| A����6 | B����3 | C����2 | D��0 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com