
����Ŀ������������������Ŀǰ����ˮ���塱������Ҫ����֮һ���乤���������£�
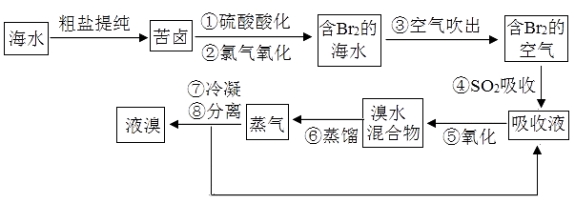
��1�����������������������ʱ��pH��3.5������������Ч����ã���ʹ�þ�ȷpH��ֽ���ܶ�����0.1����ⲽ���������������Һ��pHʱ����������ɫ�仯ʧ������pH���ʧ�ܵ�ԭ���� ��
��2��������з�Ӧ�Ļ�ѧ����ʽΪ ���÷�Ӧ��������SO2�� �ԣ����������ԭ������
��3���������������������õ�Һ������ˮ�Ļ��������ʵ�������÷�Һ©�����з���������ʱ����Һ©���������������� ��
��4������١���֮��δֱ���á���Br2�ĺ�ˮ����������õ�Һ�壬���Ǿ�������������������SO2���ա�����������������������������SO2���ա��������Ĺ���ʵ������һ��Br2�� ���̣���ֱ������Br2�ĺ�ˮ����ŵ������ĸ��ٳɱ����ͺ� ��
���𰸡���12�֣�ÿ��2�֣�
��1����Һ�е�HClO��pH��ֽƯ������2��SO2+Br2+2H2O=H2SO4+2HBr����ԭ��
��3����ˮ����4��Ũ����������Ч�ʸ�����
��������
������������������������ڹ�ҵ��ģ��ˮ����ij��÷���������һ�ֹ�������Ԥ�Ⱦ����ữ��Ũ����ˮ�У��������û�������ʹ֮��Ϊ�����壬�̶�ͨ�������ˮ���������崵����������ʹ�����������ռ���������������ת�����������Դﵽ������Ŀ�ģ�Ҳ���ǵõ������壮Ȼ�������������������õ���Ʒ�塣��1�����������������������ʱ��pH=3.5������������Ч����ã���ʹ�þ�ȷpH��ֽ���ܶ�����0.1����ⲽ���������������Һ��pHʱ����������ɫ�仯ʧ������pH���ʧ�ܵ�ԭ���ǣ���Һ�е�HClO��pH��ֽƯ�ף���2��Br2��SO2����������ԭ��Ӧ����HBr��H2SO4����Ӧ�ķ��̻�ѧ����ʽΪ��Br2��SO2��2H2O=H2SO4��2HBr����Ӧ�ж�����������Ԫ�ػ��ϼ�+4�����ߵ�+6�ۣ����ֶ�������Ļ�ԭ�ԣ���3���������������������õ�Һ������ˮ�Ļ�����ʵ���ҿ��÷�Һ©�����з��룬Һ���ܶȴ���ˮ������ʱ�ӷ�Һ©�����Ͽڵ���������ˮ����4���Ȼ���ĺ�ˮ��Ȼ�����嵥�ʣ���Ũ�ȵͣ������ͣ�Ӧ����������������SO2���ա��Ȼ����Ĺ��̽��и��������ֱ������ԭ�ϣ���Ʒ�ɱ��ߣ���ֱ������Br2�ĺ�ˮ����ŵ������ĸ��ٳɱ���Ч�ʸ��ߣ�����ֱ������Br2�ĺ�ˮ����ŵ������ĸ��ٳɱ����ͺ�Ч�ʸ��ߡ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ�ɷ�Ϊһ����Դ�Ͷ�����Դ������������ȷ������ ��
A��ˮú����һ����Դ
B����Ȼ���Ƕ�����Դ
C�������Ƕ�����Դ
D��ˮ���Ƕ�����Դ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ��Ӧ�������ȵ�˵������ȷ����
A���κο��淴Ӧ����һ�����ȣ������ǿ��Ըı��
B�����κλ�ѧ��Ӧ��˵����Ӧ����Խ��������Խ����
C��������ѧ��Ӧ���ʵ���Ҫ�������¶ȡ�Ũ�ȡ�ѹǿ
D������ϡ���ᷴӦ������ʱ������98.3%��Ũ���ᣬ������ѧ��Ӧ����������Ч
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I�����������л����У�
��CH4
��CH2��CH2
��![]()
��CH3COOH
��HOCH2CHO
��CH3CH2CH2CH3
��������
�൰����
�����
��1������Ũ���ᷢ����ɫ��Ӧ����______________������ţ���ͬ����
��2������ͬϵ����� ��
��3����Ϊͬ���칹�����___________��
��4������������Ӧ����______________��
II����5L���ܱ������г���1mol A ��2mol B����һ�������·�����Ӧ4A(g)+5B(g)![]() 4C(g)+6D(g)������Ӻ�C�����ʵ���������0.30mol��
4C(g)+6D(g)������Ӻ�C�����ʵ���������0.30mol��
��5��D��ƽ����Ӧ����Ϊ ��
��6��A��ת����Ϊ ��
��7�� �����жϸ÷�Ӧ�Ѵ�ƽ��״̬���� ��
A ����λʱ��������n mol A��ͬʱ����2n mol D��״̬
B ��������Ũ�Ȳ��ٱ仯��״̬
C ����������ƽ����Է����������ٸı��״̬
D ����������ѹǿ���ٸı��״̬
E�� �����и���ֵ������������ʱ��仯��״̬
F ��������A��B��C��D�����ʵ����ı�һ����4��5��4��6��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ú��ʯ�͡���Ȼ������Դ��˵����ȷ���ǣ� ��
A. ʯ���ѽ�õ��������Ǵ�����
B. ú���������ǽ�ú�ڸ��������ɹ�̬ת��Ϊ��̬���������仯����
C. ��Ȼ����һ�����Ļ�ʯȼ��
D. ú����̼�����ڵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧʵ�����������⻯ѧ֪ʶ���γɻ�ѧ������̽���봴��������������ѧ������
I���ھ�֧�Թ��м������Ƭ����ˮ����������ע������ȡһ����ʯ���ͣ��������Ӻ�װ�ã���ȼ�ƾ��ƣ����Ⱦ�֧�Թ��е����Ƭ����ˮ�������Ļ����Լ�����ӣ���ע�����е�ʯ���ͻ�������������֧�Թ��У�ʯ���������ȵ����Ƭ����ˮ�������Ӵ�����������������ͨ�����Ը��������Һ����ˮ�У��������Ը��������Һ����ˮ����ɫ,��������Ѹ���滻��ȼ�ռ��죬��ȼ���壬�����������к��̡�

��1�����Ƭ����ˮ��������������___________��
��2��ͨ����ʵ��˵��____________________��
II�� ʵ���ҿ����������������Ӧ�Ʊ���ˮ���Ȼ��������Ȼ������غ�ɫ���׳��⣬100������ʱ������ij��ѧ��ȤС����������ʵ��װ���Ʊ����ռ���ˮ���Ȼ�����

��3��Aװ���з�����Ӧ�����ӷ���ʽΪ ��
��4��ʵ��ʱ���ȵ�ȼA���ľƾ��ƣ���D�ܴ���ɫ�����ɫʱ���ٵ�ȼD���ľƾ��ƣ�����������Ϊ�� ��
��5��Bװ����Ӧʢ�ŵ��Լ�����Ϊ ��
��6��Fװ���������������ֹ�����е�ˮ���뷴Ӧ������ֹ��ˮ���Ȼ�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ������ ��
A��NaHSO4������״̬�µĵ��뷽��ʽΪNaHSO4�TNa++H++SO42��
B��H2CO3�����ᣬ��Na2CO3���������
C��KClO3��SO3����ˮ���ܵ��磬��KClO3��SO3Ϊ�����
D��NaHCO3��ˮ��Һ�еĵ��룺NaHCO3�TNa++HCO3����HCO3��![]() H++CO32��
H++CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���д������( )
A. �¶�Խ�ߣ�ø�Ĵ�����Խǿ
B. Ũ����ʹƤ���ʻ�ɫ������Ũ�����뵰���ʷ�������ɫ��Ӧ
C. �����յķ������Լ���ë֯�����֯��
D. �ڶ����м���������ʯ�࣬��ʹ��������Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
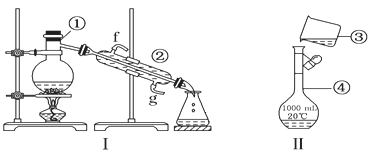
��1��д���������������ƣ�
��___________����___________����___________��
��2�������������У�ʹ��ʱ�������Ƿ�©ˮ����___________������ţ�
��3��������װ��������ƾ���ˮ�Ļ�����ȱ�ٵ�������___________��������������������е�ʵ�����������Ϊ___________�����Ľ�ˮ����___________����f��g��
��4����������250ml 0.2mol/L NaCl��Һ��װ������ijͬѧת����Һ��ʾ��ͼ��ָ��ͼ�еĴ������___________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com