
| A. | 碘酒可使蛋白质变性,故能消毒杀菌 | |
| B. | 天然氨基酸能溶于强酸或强碱溶液,在两性化合物 | |
| C. | 常温下,强酸和弱酸的浓度相同时,强酸中水的电离程度比弱酸中的大 | |
| D. | 船舶外壳装上锌块,是牺牲阳极的阴极保护法进行防腐 |
分析 A.碘酒具有杀菌消毒能力;
B.氨基酸含有氨基和羧基,可分别与酸、碱反应;
C.弱酸电离程度较小,氢离子浓度越大,越抑制水的电离;
D.锌比铁活泼,形成原电池时为负极.
解答 解:A.碘酒为碘的酒精溶液,可使蛋白质变性,具有杀菌消毒能力,故A正确;
B.氨基酸含有氨基和羧基,可分别与酸、碱反应,为两性化合物,故B正确;
C.弱酸电离程度较小,溶液中氢离子浓度较小,则水的电离程度较大,故C错误;
D.锌比铁活泼,形成原电池时为负极,为牺牲阳极的阴极保护法,可防止铁被腐蚀,故D正确.
故选C.
点评 本题考查较为综合,涉及物质的性质、电解质的电离、金属的腐蚀等知识,为高考常见题型和高频考点,侧重化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


科目:高中化学 来源: 题型:解答题
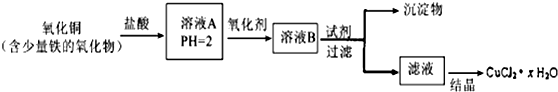
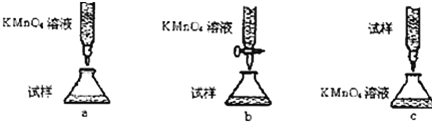
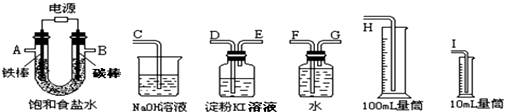
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:5 | B. | 5:4 | C. | 2:7 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 | |
| B. | 含磷污水是很好的肥料,可灌溉庄稼,能直接排放到自然界水体中 | |
| C. | 施用适量石灰乳可降低盐碱地(含较多NaCl、Na2CO3)的碱性 | |
| D. | 最理想的“原子经济”就是原子利用率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NO2与SO2能发生反应:NO2+SO2?SO3+NO,某研究小组对此进行相关实验探究.
NO2与SO2能发生反应:NO2+SO2?SO3+NO,某研究小组对此进行相关实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
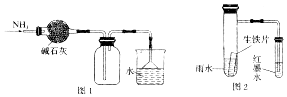
| A. | 图1所示的装置可用于干燥、收集并吸收多余的氨气 | |
| B. | 用广泛pH试纸测得0.1mol•L-1NaClO溶液的pH值约为12 | |
| C. | 用蒸发溶剂的方法将10%的Ca(HCO3)2溶液变为20%的Ca(HCO3)2溶液 | |
| D. | 用图2的装置可以验证生铁片在该雨水中是否会发生吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g质量分数为46%的乙醇水溶液中所含原子数目为0.6NA | |
| B. | 常温常压下,11.2L乙烯所含分子数目小于0.5NA | |
| C. | 常温常压下.4.4gN2O与CO2的混合气体中含的原子数目为0.3NA | |
| D. | 常温下,1molC5H12中含有共价键数为16NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,Ksp(AgI)>Ksp(AgCl) | |
| B. | 由于AgCl与AgI的饱和水溶液几乎都不导电说明这两种物质均为非电解质 | |
| C. | 分别用等体积的蒸馏水和0.01 mol/L KI溶液洗涤AgI沉淀,用水洗涤沉淀损失量大 | |
| D. | 将AgCl与AgI的饱和溶液等体积混合后,再加入足量浓AgNO3溶液,只有AgI沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com