
【题目】下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
A.亚硫酸氢钠和硫酸氢钠分别溶解在水中
B.硝酸铵与硝酸分别受热变为气体
C.氯化钠与氯化氢分别溶解在水中
D.碘与干冰分别受热变为气体
【答案】D
【解析】
A. 亚硫酸氢钠溶于水变为溶液时电离出钠离子、亚硫酸氢根离子,亚硫酸氢根离子部分电离成氢离子和亚硫酸根离子,断裂离子键、共价键,亚硫酸氢根离子水解生成亚硫酸分子,断裂水中氢氧共价键,而硫酸氢钠溶于水变为溶液时电离出钠离子、氢离子和硫酸根离子,断裂离子键与共价键,故A不选。
B. 硝酸铵为离子化合物,硝酸为共价化合物,它们分别受热变为气体发生的反应分别为:NH4NO3![]() HNO3+NH3↑,4HNO3
HNO3+NH3↑,4HNO3![]() 4NO2↑+2H2O+O2↑,前者破坏了离子键和共价键,后者破坏了共价键,故B不选。
4NO2↑+2H2O+O2↑,前者破坏了离子键和共价键,后者破坏了共价键,故B不选。
C. 氯化钠为离子化合物,氯化氢为共价化合物,分别溶解在水中,氯化钠在水中电离出钠离子和氯离子,破坏了离子键,氯化氢在水中,电离出氢离子和氯离子,破坏了共价键,故C不选。
D.碘与干冰分别受热变为气体,仍然分别为碘分子和二氧化碳分子,破坏的是分子间的作用力,故D选。
故答案选D。


科目:高中化学 来源: 题型:
【题目】298K时,用0.01molL-1NaOH溶液滴定10mL0.01molL-1H2A溶液的滴定曲线如图所示(已知:25℃时,H2A的Ka1=10-1.75,Ka2=10-7.19)。下列说法不正确的是( )
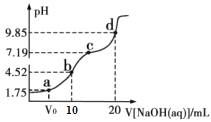
A.a点所得溶液中:V0=5mL
B.B点所得溶液中:c(H2A)+c(H+)= c(A2-)+c(OH-)
C.C点所得溶液中:c(Na+)>3 c(HA-)
D.D点所得溶液中A2-水解平衡常数Kh1=10-6.81
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含铜污泥[主要成分为Cu(OH)2、Cu2(OH)2CO3、Fe(OH)3和SiO2]为原料制备纯净的Cu2(OH)2CO3的工艺流程如下:
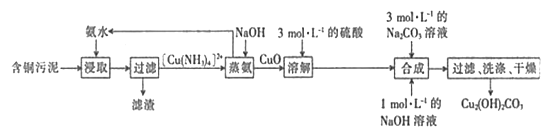
回答下列问题:
(1)为提高浸取率采取的措施是____(填字母)。
a.增大浸取与含铜污泥的投料比 b.减小氨水的浓度
c.缩短浸取的时间 d.适当提高浸取的温度
(2)合成Cu2(OH)2CO3时发生的离子方程式为__________。
(3)第一次过滤时所得滤渣的成分为________(填化学式)。
(4)经检测,该含铜污泥中铜的含量为32%,且上述工艺流程中铜的损耗率为10%,某工厂以20t这种含钢污泥为原料,经上述工艺流程后,最终可制得Cu2(OH)2CO3____t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将图中所列仪器组装为一套实验室蒸馏工业酒精的装置,并进行蒸馏。
(三) | (一) | (五) | (二) | (六) | (四) |
|
|
|
|
|
|
(1)图中Ⅰ、Ⅱ、Ⅲ三种仪器的名称是__、__、__。
(2)将以上仪器按(一)→(六)顺序,用字母a,b,c…表示连接顺序。
e接(_______),(_______)接(_______),(_______)接(_______),(_______)接(_______)。
(3)Ⅰ仪器中c口是__,d口是__。(填“进水口”或“出水口”)
(4)蒸馏时,温度计水银球应放在__位置。
(5)在Ⅱ中注入工业酒精后,加几片碎瓷片的目的是__。
(6)给Ⅱ加热,收集到沸点最低的馏分是__。收集到78℃左右的馏分是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中,不能用于实验室制取氨的是
A. 加热试管中的氯化铵固体
B. 在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
C. 将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
D. 将烧瓶中的浓氨水加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( )

A. 该晶体属于离子晶体
B. 晶体的化学式为Ba2O2
C. 该晶体晶胞结构与NaCl相似
D. 与每个Ba2+距离相等且最近的Ba2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为____________,3d能级上的未成对电子数为________。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是__________。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为________,提供孤电子对的成键原子是________。
③氨的沸点________(填“高于”或“低于”)膦(PH3),原因是___________;氨是________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为________。
(3)单质铜及镍都是由________键形成的晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CO2中,Mg燃烧生成MgO和C。下列说法正确的是( )
A. 元素C的单质只存在金刚石和石墨两种同素异形体
B. Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C. 在该反应条件下,Mg的还原性强于C的还原性
D. 该反应中化学能全部转化为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用有关概念判断下列叙述正确的是( )
A.1mol H2燃烧放出的热量为H2的燃烧热
B.Na2SO3和H2O2的反应为氧化还原反应
C.![]() 和
和![]() 互为同系物
互为同系物
D.BaSO4的水溶液不导电,故BaSO4是弱电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com