
| A、用托盘天平直接称量烧碱4.0g |
| B、在蒸发皿中灼烧CuSO4?5H2O晶体以除去结晶水 |
| C、用标准盐酸溶液滴定未知浓度的氨水,用酚酞作指示剂 |
| D、配制0.9%的氯化钠溶液时,将称量的氯化钠放入烧杯中加计量的水搅拌溶解 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 (1)已知在常温常压下:
(1)已知在常温常压下:| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
 ),聚丙烯酸钠单体的结构简式是
),聚丙烯酸钠单体的结构简式是查看答案和解析>>
科目:高中化学 来源: 题型:

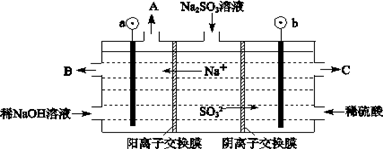
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝是地壳中含量最多的金属元素 |
| B、铝的抗腐蚀性能好,原因是铝表面的氧化膜可以阻止铝与空气中的氧气接触 |
| C、铝是一种活泼的金属,在化学反应中常作还原剂 |
| D、铝制餐具能用于蒸煮,或长时间存放碱性食物,但不适宜存放酸性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进行蒸发操作时,应将混合物中的水分完全蒸干后,才能停止加热 |
| B、进行蒸馏操作时,蒸馏烧瓶中应加入几粒沸石 |
| C、进行分液操作时,分液漏斗中下层液体先从下口放出,上层液体后从下口放出 |
| D、进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉、油脂、蛋白质都能水解,且水解产物各不相同 |
| B、从煤的干馏产物中可以获得焦炉气、粗氨水、煤焦油、焦炭等重要的化工原料 |
| C、石油催化裂化的主要目的是提高芳香烃的产量 |
| D、核酸是一类含磷的生物高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使pH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存 | ||||
B、惰性电极电解氯化铝溶液:2Cl-+2H2O
| ||||
| C、镁与极稀硝酸反应生成硝酸铵的离子方程式为:4Mg+6H++NO3-=4Mg2++NH4++3H2O | ||||
| D、将10 mL 0.1 mol?L-1 KAl(SO4)2溶液和10 mL 0.2 mol?L-1Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C(Na+)+C(H+)=C(CO32-)+C(HCO3-)+C(OH-) |
| B、C(Na+)>C(HCO3-)>C(CO32-)>C(OH-) |
| C、C(Na+)>[C(CO32-)+C(HCO3-)+C(H2CO3)] |
| D、C(CO32-)>C(HCO3-)>C(H+)>C(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com