
| A、H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体;甲醇、乙二醇和丙三醇互为同系物 |
| B、在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 |
| C、HI的相对分子质量大于HF,所以HI的沸点高于HF |
| D、由IA族和VIA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含有共价键的离子型化合物 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、0.45mol?L-1 |
| B、0.3mol?L-1 |
| C、0.15mol?L-1 |
| D、0.1mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- |
| B、电解饱和食盐水:2Cl-+H2O═2OH-+H2↑+Cl2↑ |
| C、澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| D、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(8n-m)mol |
| B、(4m-n)mol |
| C、(4n-m)mol |
| D、(7n-m)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中c(Cl?)与c(SO42?)之比为( )
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中c(Cl?)与c(SO42?)之比为( )| A、1:1 | B、2:3 |
| C、3:2 | D、2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用指南针确定航海方向 |
| B、培育新品种,增加农作物产量 |
| C、综合利用石油,合成优良人造纤维 |
| D、设计新程序,开发电脑新功能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高空臭氧层吸收太阳紫外线,保护地球生物;反应3O2═2O3有单质参加,属于氧化还原反应 |
| B、人造纤维,合成纤维和光导纤维都是有机高分子化合物 |
| C、大量燃烧化石燃料排放的废气中含大量CO2、SO2造成大气污染,从而使雨水pH=5.6形成酸雨 |
| D、加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
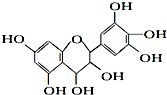
| A、该物质既可看作醇类,也可看作酚类 |
| B、1mol该物质可与4mol Br2反应 |
| C、1mol该物质可与7mol Na反应 |
| D、1mol该物质可与7mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
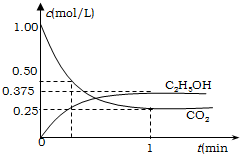 前些天在北京、西安、南昌等25个大中城市都出现雾霾天气,人类的活动改变了全球的气候.全球气候变暖已经成为全世界人类面临的重大问题.
前些天在北京、西安、南昌等25个大中城市都出现雾霾天气,人类的活动改变了全球的气候.全球气候变暖已经成为全世界人类面临的重大问题.| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com