
| A. | X原子在反应中得到的电子数比Y原子在反应中得到的电子数少 | |
| B. | 气态氢化物 Y比X稳定 | |
| C. | X的最高正价比Y的最高正价高 | |
| D. | X单质能与Y的氢化物反应生成Y单质 |
分析 非金属的非金属性越强,其单质的氧化性越强,其最高价氧化物的水化物酸性越强、其氢化物的稳定性越强,据此分析解答.
解答 解:A.X原子在反应中得到的电子数比Y原子在反应中得到的电子数少,不能说明X的非金属性比Y强,如Cl元素的非金属性大于Y,故A错误;
B.元素的非金属性越强,其氢化物的稳定性越强,气态氢化物Y比X稳定,说明Y非金属性比X强,故B错误;
C.X的最高正价比Y的最高正价高,不能说明X的非金属性大于Y,如Se的最高正价大于N元素,但非金属性N>Se,故C错误;
D.X单质能与Y的氢化物反应生成Y单质,说明X单质的氧化性大于Y,则非金属性X大于Y,故D正确;
故选D.
点评 本题考查非金属性强弱判断,为高频考点,明确非金属性强弱与单质氧化性、最高价氧化物水化物酸性、氢化物的稳定性之间关系是解本题关键,与得电子多少无关,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,A的名称是2-甲基戊烷. 若A是炔烃B氢化而成,则B的结构有2种
,A的名称是2-甲基戊烷. 若A是炔烃B氢化而成,则B的结构有2种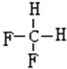 和
和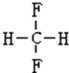 F.
F.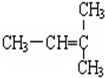 和
和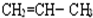 G.
G.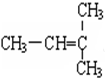 和
和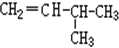
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 状态 | 密度/g•cm3 | 沸点/℃熔点/℃ |
| 乙醇 无色液体 | 0.79 | 78.5/-130 |
| 1,2-二溴乙烷 无色液体 | 2.2 | 132/9 |
| 乙醚 无色液体 | 0.71 | 34.6/-116 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
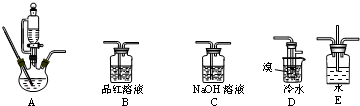
 实验室用如图装置制取少量溴苯,试填写下列空白.
实验室用如图装置制取少量溴苯,试填写下列空白.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com