
| A、②①③④ | B、①②③④ |
| C、③②①④ | D、②①④③ |
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
| 阳离子 | A13+、Ba2+、Ag+ |
| 阴离子 | C1-、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
| B、7.8gNaS和 Na2O2中含有的阴离子数等于0.1NA |
| C、50mL18.4mol L-1浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA |
| D、常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 酒后驾车已成为一个社会问题,2013年1月1日起执行的新交规对酒后驾车作出严厉的处罚规定.检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.
酒后驾车已成为一个社会问题,2013年1月1日起执行的新交规对酒后驾车作出严厉的处罚规定.检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a>b | B、a<b |
| C、a=b | D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当该反应体系平均分子质量不变时,反应体系达到平衡 |
| B、当容器中每生成1 mol H2O(1)时,放出的能量为536.0kJ |
| C、升高温度,正反应速率加快,平衡常数减小 |
| D、加入高效催化剂可以一定程度上提高NO转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2v(NH3)=v(CO2) |
| B、密闭容器中c(NH3):c(CO2)=2:1 |
| C、密闭容器中混合气体的密度不变 |
| D、密闭容器中氨气的体积分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
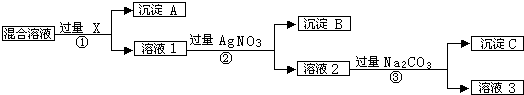
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com