
氧化二氯是黄棕色具有强烈刺激性的气体。它的熔点-116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1∶100)同时反应生成次氯酸溶液。制取少量氧化二氯,是用干燥的氧化汞与氯气反应(还生成HgO·HgCl2)。装置如图,仅铁架台和夹持仪器已略去。
部分物质的有关物理数据如下:
| 化学式 | 熔点(单位:℃) | 沸点(单位:℃) |
| N2 | -209.86 | -195.8 |
| O2 | -218.4 | -183 |
| CO2 | -57 | / |
| NH3 | -77.3 | -33.35 |
| Cl2 | -101 | -34.6 |
(12分)(1)a:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O; (2) 饱和NaCl溶液
(3)液态空气 Cl2 (4)橡胶 爆炸
解析试题分析:(1)由装置图可知,A中发生反应制备氯气,反应不需加热,深色固体试剂a与溶液b反应,通常应为高锰酸钾与浓盐酸,反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O。
(2)HCl易挥发,A中生成的氯气中含有HCl、H2O,用饱和食盐水吸收HCl,用浓硫酸干燥,先除氯化氢,后干燥,故B中盛有液体c是试剂饱和食盐水。
(3)由题目信息可知,氧化二氯气体的熔点-116℃,熔点很低,所以根据表中数据可知,应该选择沸点很低的液态空气进行制冷;根据工艺流程可知,D中反应氯气可能不能成分反应,由于氯气易液化,所以E的内管得到的氧化二氯中可能含有杂质是液氯。
(4)由信息可知,氧化二氯不稳定,接触一般有机物易爆炸,因此 Cl2O不能与有机物接触,所以A、B、C间用乳胶管连接,D、E间不能乳胶管连接。
考点:考查物质制备实验方案设计与评价的有关判断


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:实验题
(16分)工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:
回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有(写一条) 。
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是:
。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)="0.01" mol?L-1,滤液中残留的c(Ca2+)= 〔已知:Ksp(CaF2)=1.46×10-10〕,
(4)沉锰工序中,298K、c(Mn2+)为1.05 mol?L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是 。
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是 。
(6)从沉锰工序中得到纯净MnCO3的操作方法是 。
副产品A的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。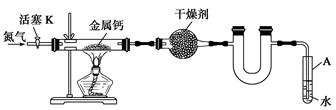
(1)反应过程中末端导管必须始终插入试管A的水中,目的是_____________________。
(2)制备氮化钙的操作步骤是:
①打开活塞K并通入N2;
②点燃酒精灯,进行反应;
③反应结束后,__________________________________________________________;
④拆除装置,取出产物。
(3)数据记录如下:(假设反应完全)
| 空硬质管质 量m0/g | 硬质管与钙的 质量m1/g | 硬质管与产物 的质量m2/g |
| 14.80 | 15.08 | 15.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
无水氯化铝是一种重要的有机合成催化剂,还可用于金属冶炼、润滑油合成;食品级无水氯化铝也可用作膨松剂、絮凝剂等。
某研究性学习小组查阅资料后利用下图所示装置制备无水氯化铝。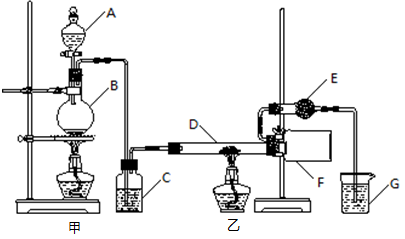
资料显示:氯化铝为无色透明晶体或白色而微带浅黄色的结晶性粉末,在178℃升华,其蒸气是缔合分子(Al2Cl6),在空气中能吸收水分,发生水解。
(1)填写下列仪器的名称:A ,B 。
(2)装置C中盛装的试剂是 ;装置G中盛装的试剂是 。
(3)相同条件下,氯化铝蒸气对氢气的相对密度是 。
(4)装置F中的现象是 。
(5)装置E的作用是 。
(6)实验结束后应先撤去 (填“甲”或“乙”)处的酒精灯。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室以空气(O2体积分数20%)为原料,在无碳、无水的环境下,用下图A装置制备臭氧(3O2 2O3)。
2O3)。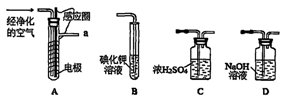
(1)空气通入A装置之前,应先后通过上述装置中的 、 (填装置序号)。
(2)臭氧与碘化钾溶液反应为:2KI+O3+H2O=2KOH+I2+O2。将a处气体通入装置B,溶液中的现象为 。
(3)为测定O2转化为O3的转化率,将装置B中的溶液全部转入另一容器中,加入CC14,经萃取、分液、蒸馏、冷却、称重,得I2固体0.254g。
①萃取操作所用玻璃仪器的名称 。
②若实验时通入空气1.12L(标准状况),O2的转化率为 。
③测定时需在A、B装置间连接装置D,原因是 。
(4)工业上分离O3和O2,可将混合气体液化后再分离,下列分离方法合理的是 (填序号)。
A.过滤 B.分馏 C.分液 D.萃取
(5)臭氧可用于含CN一碱性电镀废水的处理。第i步:CN一转化为OCN-;第ii步:OCN一继续转化为CO32一及两种单质气体。若第ii步转化时,O3与OCN-物质的质量之比为3∶2,该步反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
利用如图装置探究氯气和氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为较纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式为 。
(2)装置A中的烧瓶内固体宜选用 (选填以下选项的代号)
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)按A接B接C;F接E接D接C,请在各虚线框内画上合适的装置图并注明所装试剂名称:
(4)在C中观察到大量白烟,同时产生一种气体单质,该反应的化学方程式为 ,反应中氧化剂与还原剂的物质的量比为 。设计一个实验方案鉴定该固体是氯化铵(要求写出操作、现象及结论): 。
(5)从装置C的G处逸出的尾气可能含有污染环境的气体,如何处理:
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氮及其化合物在生产、生活中有重要的作用。
(1)NH3是制碱工业中不可缺少的重要物质。继侯德榜“联合制碱法”后,上世纪50年代某些化工专家开始研究有机胺制碱法,其工艺流程如下: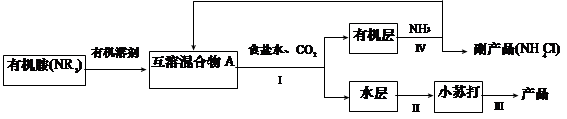
已知:NR3 + CO2 + NaCl + H2O = NaHCO3 + NR3·HCl
NR3 + HCl = NR3·HCl,且NR3·HCl 易溶于有机溶剂。
①操作Ⅰ名称为 ;
②某实验小组同学查阅资料知,有机溶剂和有机胺沸点差别较大,现欲将A中各成分进行分离,请写出除了导管、酒精灯、牛角管、锥形瓶外,该分离操作所需的玻璃仪器名称 ;
(2)N2在化工生产、农业、医疗、航天航空等领域用途广泛。现提供以下装置(连接仪器略去):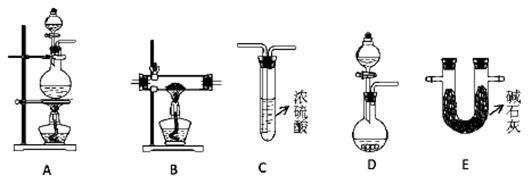
①某化学兴趣小组甲同学欲用加热NaNO2 和NH4Cl的浓溶液制得N2,应该选择的发生装置是 ,检验该发生装置气密性的操作为 ;
②在加热条件下,用NH3 还原CuO可制得N2,同时获得铜粉,此反应的化学方应方程式是 。乙同学用此法制得干燥、纯净的N2,且需要的NH3 以生石灰和浓氨水作原料。按气流从左到右,整套装置的连接顺序是 (填写字母序号);最后一个装置中试剂的作用是 ;
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
无水FeCl3呈棕红色,极易潮解,100℃左右时升华,工业上常用作有机合成催化剂。实验室可用下列装置(夹持仪器略去)制备并收集无水FeCl3。
请回答:
(1)装置A中反应的离子方程式为 。
(2)装置F中所加的试剂为 。
(3)导管b的作用为 ;
装置B的作用为 。
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,原因为 。
(5)反应结束后,拆卸装置前,必须进行的操作是
(6)为检验所得产品中是否含有FeCl2,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入一种试剂,该试剂为 (填序号)。
①Fe粉 ②KSCN溶液 ③酸性KMnO4溶液 ④NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com