

| A. | 不能用FeCl3 溶液鉴别水杨酸和阿司匹林 | |
| B. | 服用阿司匹林出现水杨酸反应时,可静脉注射NaHCO3溶液 | |
| C. | 1 mol阿司匹林最多可消耗2 mol NaOH | |
| D. | 该反应不属于取代反应 |
分析 A.水杨酸含有酚羟基,可与氯化铁反应;
B.水杨酸含有羧基,可与碳酸氢钠反应;
C.阿司匹林含有羧基和酯基,都可与氢氧化钠溶液反应;
D.根据取代反应的定义判断.
解答 解:A.水杨酸含有酚羟基,可与氯化铁反应,而阿司匹林不反应,可鉴别,故A错误;
B.水杨酸含有羧基,可与碳酸氢钠反应,故B正确;
C.阿司匹林含有羧基和酯基,都可与氢氧化钠溶液反应,且酯基可水解生成酚羟基和羧基,则1 mol阿司匹林最多可消耗3 mol NaOH,故C错误;
D.反应属于取代反应,故D错误.
故选B.
点评 本题考查较为综合,涉及有机物的结构和性质以及物质的检验等知识,综合考查学生化学知识的应用能力和实验能力,为高考常见题型,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 气体甲可与Z的某种氢化物反应生成强酸 | |
| B. | 化合物乙中一定只含共价键 | |
| C. | W和Z元素形成的化合物中只含极性键 | |
| D. | X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
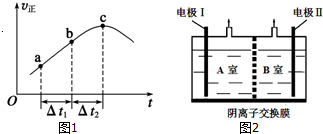
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C4H12O2 | B. | C3H8O | C. | C2H6O | D. | C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
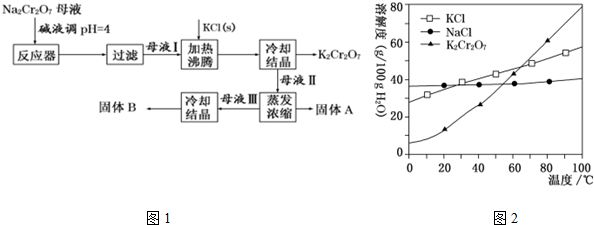
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铵受热气化和苯的汽化 | B. | 碘和干冰受热升华 | ||
| C. | 二氧化硅和生石灰的熔化 | D. | 氯化钠和铁的熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol/LCH3COOH溶液中所含分子总数 | |
| B. | 1molCl2参加化学反应获得的电子数 | |
| C. | 常温常压下,11.2LN2和NO的混合气体所含的原子数 | |
| D. | 28g铁在反应中作还原剂时,失去电子的数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成气体体积为560mL | B. | 反应中电子转移数目为0.1NA | ||
| C. | Na2O2粉末中含离子数目为0.15NA | D. | 所得溶液pH为13 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
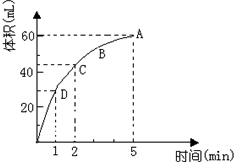 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示(假设溶液体积不变),回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示(假设溶液体积不变),回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com