
| A. | 25% | B. | 27.5% | C. | 30% | D. | 37.5% |
分析 设原混合气体中氮气的体积为a mL,则氢气的体积为(100-a)mL,令参加反应的氮气为x mL,利用三段式表示出平衡时各物质的体积,混合气体总质量不变,则密度与体积成反比,据此列方程计算x的值,从而求氨气的体积分数,由此分析解答.
解答 解:设原混合气体中氮气的体积为a mL,则氢气的体积为(100-a)mL,令参加反应的氮气为x mL,则:
N2 +3 H2 ?2 NH3
起始(L):a 100-a 0
转化(L):x 3x 2x
平衡(L):a-x 100-a-3x 2x
混合气体总质量不变,则密度与体积成反比,则有:$\frac{100}{100-2x}$=1.25,解得x=10,
混合气体体积减少量等于氨气的体积,所以氨气的体积分数为$\frac{20}{100-20}$×100%=25%,故选A.
点评 本题考查化学平衡有关计算,题目计算量较大,侧重考查学生的分析计算能力,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3 Fe2O3 | B. | Fe(OH)2 Fe2O3 | C. | Fe(OH)2 Fe(OH)3 | D. | Fe(OH)2 Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物的稳定性:甲>乙>丙 | |
| B. | 甲、丙两元素最高价氧化物对应水化物的酸性强弱:甲<丙 | |
| C. | 原子半径的大小:甲>乙 | |
| D. | 乙元素的族序数比甲元素的族序数大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 气体的颜色不再发生变化 | |
| B. | 容器内的压强不再发生变化 | |
| C. | 单位时间内,每断裂2mol H-I键,同时有1mol I-I键生成 | |
| D. | 单位时间内,每断裂1mol H-H键,同时有1mol I-I键生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
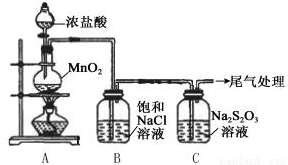
| 操作 | 现象 |
| 打开分液漏斗活塞,滴加一定量浓盐酸,加热 | i.A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii.一段时间后,C中产生大量黄色沉淀. |
| 用湿润的淀粉碘化钾试纸检验C中白雾 | 淀粉碘化钾试纸变蓝 |
| C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 | 有白色沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com