
һ���¶��£���2L���ܱ������з�����Ӧ��xA(g)+B(g) 2C(g) ��H<0��A��C�����ʵ�����ʱ��仯�Ĺ�ϵ���ұ���ʾ�������й�˵����ȷ����
2C(g) ��H<0��A��C�����ʵ�����ʱ��仯�Ĺ�ϵ���ұ���ʾ�������й�˵����ȷ����
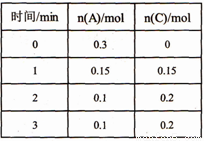
A. x=1
B. ��Ӧ��ʼ2min�ڣ���B��ʾ�ķ�Ӧ����Ϊ0.05mol �� L-l �� min -1
C. ��Ӧ���е�lminʱ����Ӧ��ϵ�ﵽ��ѧƽ��״̬
D. A������Ӧ���ʵ���C���淴Ӧ����ʱ����Ӧ��ϵ�ﵽ��ѧƽ��״̬
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�����и�һ��ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪Ԫ�ص�����aAn+��bB(n+1)+��cCn-��dD(n+1)-������ͬ��������Ԫ���γɵļ����ӡ�����������ȷ���ǣ� ��
A. ԭ�Ӱ뾶: C > D > A > B B. ԭ��������C > D > B > A
C. ���Ӱ뾶��D > C > B > A D. ���ʵĻ�ԭ�ԣ�B > A > C > D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017������ʡ��˳�и���3��ģ�⿼�������ۺϻ�ѧ�Ծ��������棩 ���ͣ������
�¹���ѧ�ҹ���(F. Haber, 1868-1930)�����ĺϳɰ�����ʹ�����еĵ���������������ʵ������ݽߵ�������Դ���Ӷ�ʹũҵ�������������ij̶ȼ���������˵���������ʳ���㵼�µļ������������⡣�����λ���������ʳΣ���Ļ�ѧ��Ż����1918��ŵ������ѧ��������������ʵ����ģ�ҵ�ư��Ĺ��̣���̽�����������ƽ���Ӱ�졣
�������ϣ�������¼������ݣ�
��ѧ�� | N��N | H-H | N-H |
����/(kJ/mol) | 946 | 436 | 391 |
(1)���㹤ҵ�ϳɰ���Ӧ�ķ�Ӧ�ȣ�N2(g)+3H2(g)  2NH3(g) ��H=________ kJ/mol
2NH3(g) ��H=________ kJ/mol
(2)һ���¶��£���һ����ѹ�����г���N20.6mol��H2 0 .5mol����һ���¶��½��з�Ӧ��N2(g)+3H2(g)  2NH3(g)���ﵽƽ��ʱ��N2��ת����Ϊ1/6����ʱ���������Ϊ1L��
2NH3(g)���ﵽƽ��ʱ��N2��ת����Ϊ1/6����ʱ���������Ϊ1L��
�ٸ��¶�ʱ������ƽ����ϵ��ƽ�ⳣ����______________��
��������ƽ��ʱ���¶Ⱥ�ѹǿ���䣬������ƽ����ϵ��ͨ��0.9mol N2����ƽ�⽫_______(�������������)�ƶ���
(3)������ѹǿ��ȣ��¶ȷֱ�ΪT1��T2�������г�����1 mol N2��3 molH2��ɵĻ�����壬������ӦN2(g)+3H2(g)  2NH3(g)��ƽ���ı���������������� N2�����������ѹǿ�ı仯��ͼ��ʾ����ͼ�ж�����˵����ȷ����______________
2NH3(g)��ƽ���ı���������������� N2�����������ѹǿ�ı仯��ͼ��ʾ����ͼ�ж�����˵����ȷ����______________
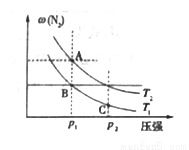
a.A�� B�� C�����ƽ�ⳣ����С��ϵ��KA<KB<KC
b.B���C���H2Ũ�ȴ�С��ϵ��B<C
c.A���B����������ܶȴ�С��ϵ��A<B
d.A���C���������ƽ����Է���������С��ϵ��A>C
(4)�ϳɰ���ҵ���������������CO2����ҵ�ϳ��ø�Ũ�ȵ�K2CO3��Һ����CO2��,����ҺX�������õ�ⷨK2CO3��Һ��������װ����ͼ��ʾ��
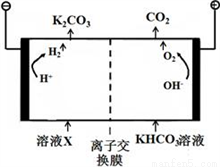
���������������ķ�Ӧ����____________________��H++ HCO3-=H2O+CO2����
�ڼ���CO32-��������������ԭ��________________��
������װ���в�����CO2��H2��һ�������·�Ӧ���ɼ״�����ҵ�����ø÷�Ӧ�ϳɼ״���
��֪��25 �棬101 KPa�£�
2H2(g)+ O2(g)=2H2O(g) �� H1=-484kJ/mol
2CH3OH(g)+3 O2(g)=2CO2 (g)+4H2O(g) �� H2=-1352kJ/mol
д��CO2��H2����1molCH3OH(g)���Ȼ�ѧ����ʽ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���㽭ʡ�����и����¸߿�ѡ����Ӧ�Կ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ����������ͨ��50mL 10.00mol��L-1����������Ũ��Һ�У���������ʱ�����Һ���γ�NaCl��NaClO��NaClO3������ϵ��������������ˮ�ķ�Ӧ��������˵����ȷ����
A. ����Ӧ��ת�Ƶĵ���Ϊnmol����0.25 < n < 0.5
B. ��Һ��n(NaCl)��n(NaClO)��n(NaClO3)����Ϊ3
C. ��NaOH��Ӧ���������ʵ�����0.25 mol < n (Cl2) < 0.75mol
D. ����Һ��n(NaClO)��n(NaClO3) = 5��1ʱ����Ӧ�����ӷ���ʽΪ��8Cl2+16OH-=10Cl-+5ClO-+ClO3-+8H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���㽭ʡ�����и����¸߿�ѡ����Ӧ�Կ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
пһ������أ�ԭ����ͼ�������������е綯���Ķ�����Դ���õ�طŵ�ʱZnת��ΪZnO���õ�ع���ʱ������˵����ȷ����
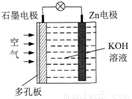
A. Zn�缫�Ǹõ�ص�����
B. Zn�缫�ĵ缫��Ӧ��Zn+H2O-2e-=ZnO+2H+
C. OH-��ʯī�缫�ƶ�
D. ������ʯī�缫�Ϸ�����ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���㽭ʡ�����и����¸߿�ѡ����Ӧ�Կ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���б�ʾ��ȷ����
A. ������Ϊ53��������Ϊ78�ĵ�ԭ�ӣ�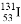
B. CH4���ӵı���ģ�ͣ�
C. Na+ �Ľṹʾ��ͼ��
D. NaOH�ĵ��뷽��ʽ��NaOH Na++ OH-
Na++ OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�������ʡ�����и����ڶ��ν�ѧ������⣨��ģ�������ۺϻ�ѧ�Ծ��������棩 ���ͣ������
��Ʒ������Ϊ������������������ҽҩ���ܼ����ϳɦ�-��Ʒ��G��·��֮һ���£�
��֪��
��ش��������⣺
��1��A�ķ���ʽΪ______��G���������ŵ�������______��
��2��C��D�ķ�Ӧ����Ϊ____���÷�Ӧ�ĸ���������D��Ϊͬ���칹��Ļ�����Ľṹ��ʽΪ______��
��3��E��F��Ӧ�м����Լ�ŨH2SO4��������_______��F�л�������C2H5OH��E�������_____������ĸ��ϴ�ӳ�ȥ��
A.ˮ B.����������Һ C.Ũ���� D.����̼������Һ
��5��B��һ�������·����ۺϷ�Ӧ�Ļ�ѧ����ʽΪ______��д��ͬʱ��������������B����״ͬ���칹��Ľṹ��ʽ________��
�ٺ˴Ź���������2�����շ塣 ���ܷ���������Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�긣��ʡ�ĵ���У�߶���ѧ�ڵ�һ��������3�£���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪�����Ȼ�ѧ����ʽ���£�
(l)  + H2(g) ��
+ H2(g) ��  (l) ��H��0 �٣�
(l) ��H��0 �٣�
(l)  + 2H2(g) ��
+ 2H2(g) ��  (l) ��H��0 �ڡ�
(l) ��H��0 �ڡ�
�������й�˵������ȷ����( )
A. ��Ӧ�١��ڵ���ЧӦ˵�������к��еIJ�����̼̼˫��
B. ��Ӧ�١��ڶ����ڼӳɷ�Ӧ
C. �� ��1��3һ������ϩ���ȶ�
D. ��Ӧ�١����е������л������ʹ��ˮ����ɫ������ɫԭ��Ҳ��ȫ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ɽ��ʡ�����и�����һ��ģ�⣨3�£������ۺϻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£�����ͬ���ʵ���Ũ�ȵ�HC1��Һ���ֱ�ζ����ʵ���Ũ�Ⱦ�Ϊ0.1mol��L-1�������ּ�(AOH��BOH��DOH)��Һ���ζ���������ͼ��ʾ�������ж���ȷ����
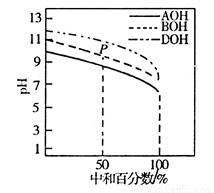
A. �ζ�ʱ������������Һ�ĵ��룬ˮ�������c(H+)ʼ������
B. �ζ���P��ʱ����Һ�У�c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
C. pH=7ʱ��������Һ��c(C1-)���
D. ���кͰٷ�����100��ʱ����������Һ��Ϻ�c(AOH)+c(BOH)+c(DOH)=c(H+)��c(OH-)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com