
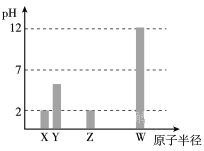
【题目】X、Y、Z、W均为常见的短周期主族元素,常温下,其最高价氧化物对应的水化物溶液(浓度均为 0.01mol/L)的pH和原子半径的关系如下图所示。其中,Y为碳元素。下列有关说法正确的是
A. X是硫元素
B. Y的最高价氧化物的电子式为 ![]()
C. W的最高价氧化物对应的水化物中仅含离子键
D. Z的最高价氧化物对应水化物的化学式为HClO4
【答案】D
【解析】
X、Y、Z、W均为短周期主族元素,由其最高价氧化物对应水化物的pH和原子序数的关系图可以知道,X、Z对应的pH为2,高氯酸、硝酸均为一元强酸,原子半径Z>Y>X,Y为C,可以知道Z为Cl,X为N,W对应的pH为12,氢氧化钠为一元强碱,则W为Na,以此来解答。
由上述分析可以知道,X为N,Y为C,Z为Cl,W为Na,
A. X为N元素,不可能为硫元素,故A错误;
B. Y为C元素,其最高氧化物为CO2,电子式为![]() ,故B错误;
,故B错误;
C. W为Na元素,其最高价氧化物对应的水化物为NaOH,既含有离子键又含有共价键,故C错误;
D. Z为Cl元素,其最高价氧化物对应的水化物为HClO4,所以D选项是正确的。
所以D选项是正确的。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】铝土矿是工业上制备金属铝的主要原料,其主要成分是Al2O3,同时还含有SiO2 和Fe2O3。工业上可使用碱浸法提取铝土矿中的 Al2O3,其工业流程如图所示。根据图示信息,回答下列问题。
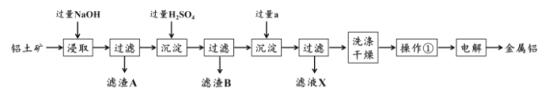
(1)为了提高铝土矿的浸取效率,可采用的方法是:______。
(2)第一次沉淀时发生了一系列离子反应,除了生成固体 B 的反应外,还有另外两个反应,请分别写出它们的离子方程式:_______,______。
(3)液体试剂 a 的化学式为_________。
(4)该工艺的副产品存在于滤液 X 中,除 Na2SO4 外,其主要成分是________ (填化学式)。试列举一项该副产品在工业生产或日常生活中的用途:________。
(5)操作①的名称为____。若在实验室中进行该操作,样品应放置在_______中。
(6)最后一步电解时往往需要加入适量冰晶石,其作用是 __________。
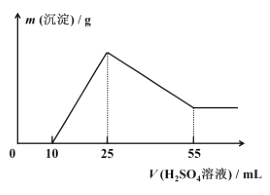
(7)取 10.0 g 铝土矿按照上述工艺进行处理,并在工艺中使用 5.0 mol/L 的稀硫酸。第一次沉淀时所得沉淀的质量与加入硫酸的体积变化关系如图所示。则该铝土矿样品中 Al2O3 的质量分数为 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
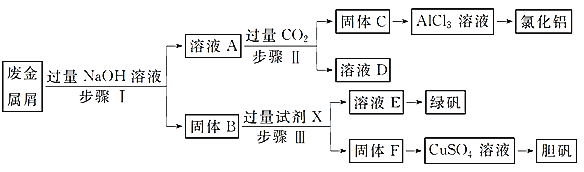
【题目】某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
请回答:
⑴写出步骤Ⅰ反应的离子方程式:_______________________。
⑵试剂X是______________。D是______________。
⑶在步骤Ⅱ时,用如图装置制取CO2并通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是_____________________。
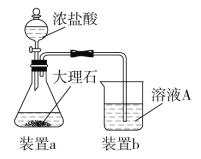
⑷由固体F制取硫酸铜溶液,通常有两种方案:
方案一:将固体F在加热条件下与浓硫酸反应;
方案二:将固体F投入热的稀硫酸中,然后通入氧气;
方法一的缺点为:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系如图所示,则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
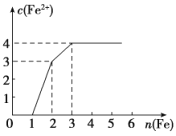
A.1∶1∶1B.1∶3∶1
C.3∶3∶8D.1∶1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,使用pH计测定0.1mol/LNH4Cl溶液的pH=5.12(如图)由此可以得到的结论是___(填字母)。

a.NH3·H2O是弱碱
b.溶液中c(H+)>c(OH-)
c.NH4+水解是吸热反应
d.由H2O电离出的c(H+)<10-7mol/L
e.物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(2)室温下,用0.10mol/LNaOH溶液分别滴定20.00mL0.10mol/L的盐酸和醋酸,滴定曲线如图所示

①表示滴定盐酸的曲线是_____(填序号)。
②若此实验选用酚酞为指示剂,则滴定到达终点的现象是_____。
③若用标准NaOH溶液测定未知盐酸溶液的浓度,下列实验操作会使实验结果偏低的是_____。
a.锥形瓶用待测液润洗后再注入待测液
b.碱式滴定管滴定前有气泡,滴定后无气泡
c.碱式滴定管滴定前仰视读数,滴定后平视读数
②在滴定醋酸溶液的过程中:V(NaOH)=10.00mL时,溶液中离子浓度由大到小的顺序为____________。当c(Na+)=c(CH3COO-)+c(CH3COOH)时,溶液pH________7(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O],其相对分子质量为392,在空气中不易被氧化,易溶于水,不溶于乙醇,100℃时易失去结晶水。现用FeSO4溶液与(NH4)2SO4反应,制取硫酸亚铁铵晶体,其流程如图所示:
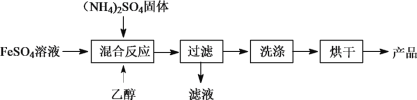
(1)“混合反应”时温度需控制在70~80℃,可采取的措施是___________,该过程中乙醇的作用是___________。
(2)现对制得的硫酸亚铁铵晶体进行纯度测定:准确称取4.000g上述硫酸亚铁铵晶体置于锥形瓶中溶解,加适量稀硫酸酸化,用0.100mol·L-1标准KMnO4溶液进行反应,当![]() 恰好完全被还原为Mn2+时,消耗KMnO4溶液的体积为20.00mL。
恰好完全被还原为Mn2+时,消耗KMnO4溶液的体积为20.00mL。
已知:![]() +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O
①若用稀盐酸替代稀硫酸进行酸化,则实际消耗的标准KMnO4溶液的体积___________20.00mL。(填“大于”或“小于”或“等于”)
②试通过计算,求该硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]的纯度(写出计算过程)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化不能实现的是
A.CH4![]() H2
H2![]() H2OB.N2
H2OB.N2![]() NH3
NH3![]() NH4Cl
NH4Cl
C.Cu![]() NO2
NO2![]() HNO3D.CH2=CH2
HNO3D.CH2=CH2![]() CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如下图所示:
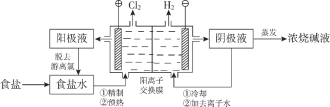
(1)电解饱和食盐水的化学方程式为________。
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是________(填字母序号)。
a.Na2SO4b.Na2SO3
c.热空气吹出d.降低阳极区液面上方的气压
(3)食盐水中的I—若进入电解槽,可被电解产生的Cl2氧化为ICl,并进一步转化为IO3—。IO3—可继续被氧化为高碘酸根(IO4—),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
①从原子结构的角度解释ICl中碘元素的化合价为+1价的原因:________。
②NaIO3被氧化为NaIO4的化学方程式为________。
(4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如下图所示。已知:吸光度越高表明该体系中c(I2)越大。
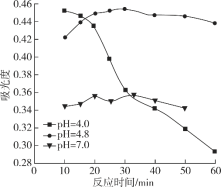
①结合化学用语解释10 min时不同pH体系吸光度不同的原因:________。
②pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因:________。
③研究表明食盐水中I-含量≤0.2 mgL-1时对离子交换膜影响可忽略。现将1m3含I-浓度为1.47 mgL-1 的食盐水进行处理,为达到使用标准,理论上至少需要0.05 molL-1 NaClO溶液________L。(已知NaClO的反应产物为NaCl,溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X、Y、M相互转化关系如下。下列有关说法不正确的是
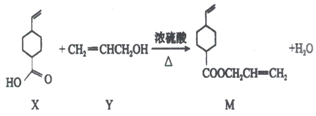
A. 可用碳酸氢钠区别X与Y
B. Y中所有原子在同一平面上
C. X、Y、M均能发生加成、氧化和取代反应
D. X环上的二氯代物共有11种(不考虑顺反异构)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com