


科目:高中化学 来源: 题型:
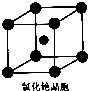 《物质结构与性质》
《物质结构与性质》

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (K) |
7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
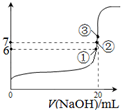 ,下列说法正确的是
,下列说法正确的是 SO2Cl2(l)△H=-97.3kJ?mol-1
SO2Cl2(l)△H=-97.3kJ?mol-1查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省苏州市高三调研测试化学试卷(解析版) 题型:填空题
从原子、分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索,研究不同类型物质的有关性质;从物质结构决定性质的视角预测物质的有关性质。

(1)下列说法正确的是 (填序号)。
A.元素电负性由大到小的顺序为:F>O>N
B.一个苯分子含3个π键和6个σ键
C.氯化钠和氯化铯晶体中氯离子的配位数相同
D.第一电离能的大小为:Br>Se>As
(2)根据等电子体原理,羰基硫(OCS)分子的结构式应为 。光气(COC12)分子内各原子最外层都满足8电子稳定结构,则光气分子的空间构型为 (用文字描述)。
(3)Cu2+基态电子排布式为 。向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4晶体,该物质中配位原子的杂化方式为 ,若不考虑空间构型,其内界结构可用示意图表示为 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.25℃时0.08mol/L二元酸H2A的溶液中pH=1,则NaHA溶液中c(H2A)>c(A2-) |
| B.浓度相同的①NH4HSO4、②(NH4)2CO3、③CH3COONH4溶液中,①的c(NH4+)最大 |
| C.若在测得pH=a溶液中加水稀释,则该溶液pH一定增大或减小 |
| D.在①CH3COONa②NH3③K2S溶液中,③含粒子种类最多且有7种粒子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com