
| A. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 | |
| B. | “光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关 | |
| C. | 使用含12C的产品,减少使用含13C或14C的产品符合“促进低碳经济”宗旨 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
分析 A.高铁酸钾具有强氧化性,可致蛋白质发生氧化而变性,高铁酸钾被还原生成Fe3+,水解生成具有吸附性的Fe(OH)3胶体而达到净水作用;
B.光化学烟雾是汽车、工厂等污染源排入大气的碳氢化合物(HC)和氮氧化物(NOx)等一次污染物在阳光(紫外光)作用下会发生光化学反应生成二次污染物,所以与光化学烟雾的形成关系密切的是氮氧化物,旱涝等灾害频繁.冰箱、空调等制冷设备排放出的氯氟化合物破坏高空的臭氧层;
C.低碳经济是以低能耗、低污染、低排放为基础的经济模式,低排放指减少二氧化碳的排放;
D.二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱发生反应.
解答 解:A.高铁酸钾具有强氧化性,可致蛋白质发生氧化而变性,高铁酸钾被还原生成Fe3+,水解生成具有吸附性的Fe(OH)3胶体而达到净水作用,既能杀菌消毒又能净水,故A正确;
B.导致臭氧空洞的物质主要是氟利昂,另外二氧化氮也导致臭氧空洞,二氧化氮、碳氢化合物是形成光化学烟雾的主要污染物,故B正确;
C.使用含12C的产品,减少使用含13C或14C的产品,未减少二氧化碳的排放,不符合“促进低碳经济”宗旨,故C错误;
D.二氧化硅具有对光良好的全反射作用,广泛用于制作光导纤维,光导纤维遭遇强碱发生反应SiO2+2OH-=SiO32-+H2O,可发生“断路”,故D正确;
故选C.
点评 本题考查化学与环境、材料、信息、能源关系密切有关知识,为高频考点,侧重于化学与生活、环境的考查,有利于培养学生良好的科学素养,掌握高铁酸钾的性质以及反应原理、了解“光化学烟雾”、“臭氧空洞”的成因、低碳经济”宗旨,以及光导纤维的成分性质是解答的关键,题目难度不大,平时注意把握相关物质的性质及应用,学习中注意积累.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
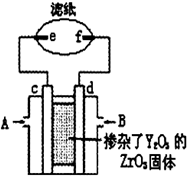 向新型燃料电池的两极分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传到O2-,图中滤纸用含有酚酞的氯化钠溶液浸泡过,c、d、e、f均为惰性电极,工作后e极周围变红,下列叙述正确的是( )
向新型燃料电池的两极分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传到O2-,图中滤纸用含有酚酞的氯化钠溶液浸泡过,c、d、e、f均为惰性电极,工作后e极周围变红,下列叙述正确的是( )| A. | c极为正极,A处通入甲烷气体 | B. | d极的反应式为O2+2H2O+4e-=4OH- | ||
| C. | 固体电解质中O2-由d极向c极移动 | D. | e极上发生氧化反应,pH上升 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和BaCl2溶液 阴极:Ba2++2e-=Ba | |
| B. | 电解Cu(NO3)2溶液 阴极:Cu2++2e-=Cu | |
| C. | 电解熔融NaCl阴极:Na++e-=Na | |
| D. | 电解NaOH溶液 阳极:4OH--4e-=2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
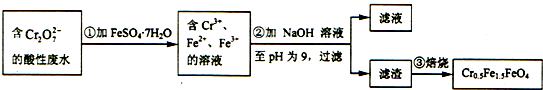
| A. | 根据第①步反应可知还原性:Cr3+大于Fe2+ | |
| B. | 第②步过滤得到的滤渣中主要成分为Cr(OH)3、Fe(OH)2,不含Fe(OH)3 | |
| C. | 欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4,理论上需要加入27.8g FeSO4•7H2O | |
| D. | 第③步高温焙烧过程用到的主要实验仪器中属于硅酸盐质的有:酒精灯、蒸发皿、泥三角 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 中和热是在稀溶液中,酸和碱反应生成1mol水所放出的热量.某同学利用50mL 0,.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和热测定的实验,回答下列问题:
中和热是在稀溶液中,酸和碱反应生成1mol水所放出的热量.某同学利用50mL 0,.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和热测定的实验,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
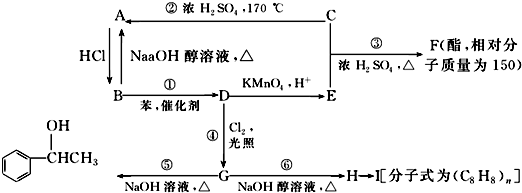
 .
. ;
; .
.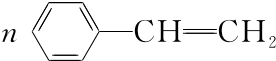 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$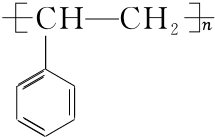 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
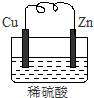 由铜片、锌片和200ml稀H2SO4组成的原电池中,一段时间后某极产生3.36L(标准状况)的气体.
由铜片、锌片和200ml稀H2SO4组成的原电池中,一段时间后某极产生3.36L(标准状况)的气体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com