
分析 粗食盐常含有少量Ca2+、Mg2+、SO42-、泥沙等杂质离子,加热溶解后,加NaOH除去Mg2+,加氯化钡除去SO42-,加碳酸钠除去Ca2+、Ba2+,碳酸钠一定在氯化钡之后,然后过滤,滤液中加盐酸除去过量碳酸钠溶液,调节pH后蒸发浓缩即可,据此回答.
解答 解:粗食盐常含有少量Ca2+、Mg2+、SO42-、泥沙等杂质离子,第一步是过滤将泥沙除去,第二步:加NaOH除去Mg2+,即2NaOH+MgCl2=Mg(OH)2↓+2NaCl,第三步:加氯化钡除去SO42-,反应为:Na2SO4+BaCl2=BaSO4↓+2NaCl,第四步加碳酸钠除去Ca2+、Ba2+,即Na2CO3+BaCl2=BaCO3↓+2NaCl,Na2CO3+CaCl2=CaCO3↓+2NaCl,然后过滤,滤液中加盐酸除去过量碳酸钠溶液和氢氧化钠,反应为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaOH+HCl=NaCl+H2O,最后一步是蒸发,
故答案为:①;2NaOH+MgCl2=Mg(OH)2↓+2NaCl;④;Na2SO4+BaCl2=BaSO4↓+2NaCl;③;Na2CO3+BaCl2=BaCO3↓+2NaCl,Na2CO3+CaCl2=CaCO3↓+2NaCl;②,Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaOH+HCl=NaCl+H2O.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、流程中发生的反应、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意碳酸钠一定在氯化钡之后,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①④②③ | B. | ④①②③ | C. | ②④①③ | D. | ④②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
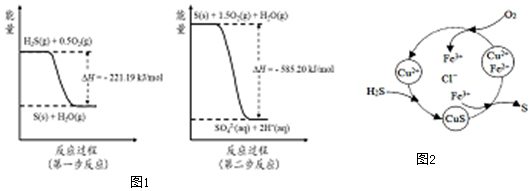
科目:高中化学 来源: 题型:多选题
 已知:2CO(g)+O2(g)?2CO2(g)△H=-566kJ/mol;
已知:2CO(g)+O2(g)?2CO2(g)△H=-566kJ/mol;| A. | CO(g)与Na2O2(s)反应放出509kJ热量时,消耗的CO是28g | |
| B. | 如图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO的燃烧热为-566 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | a=b | C. | a<b | D. | 2a=b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验I | 实验II | 实验III | |
| 反应温度/℃ | 800 | 800 | 850 |
| c( A)起始/mol•L-1 | 1 | 2 | 1 |
| c( A)平衡/mol•L-1 | 0.5 | 1 | 0.85 |
| 放出的热量/kJ | a | b | c |
| A. | 化学平衡常数实验III的小于实验I的 | |
| B. | 实验放出的热量关系为b>2a | |
| C. | 实验III 在30min达到平衡,用A表示此段时间的平均反应速率v (A)为0.005mol•L-1•min-1 | |
| D. | 当容器内气体密度不随时间而变化时上述反应已达平衡 |
查看答案和解析>>
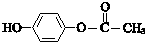
科目:高中化学 来源: 题型:推断题
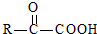 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$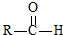 +H2O
+H2O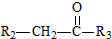 $→_{△}^{NaOH(aq)}$
$→_{△}^{NaOH(aq)}$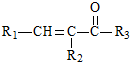 +H2O
+H2O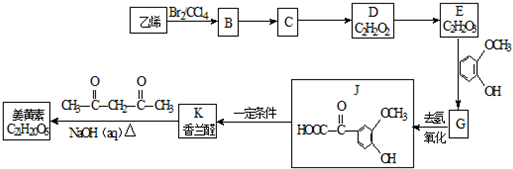
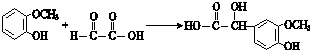 .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲的摩尔体积比乙的摩尔体积小 | |
| B. | 甲的物质的量比乙的物质的量多 | |
| C. | 甲的相对分子质量比乙的相对分子质量小 | |
| D. | 甲的分子数比乙的分子数少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.050 |
| 4 | 0.050 | 0.025 |
| 5 | 0.040 | |
| 8 | 0.020 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com