
【题目】炼锌厂的铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。对这些元素进行提取分离能减少环境污染,同时制得ZnSO4·7H2O实现资源的再利用。其流程图如下。已知FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。

金属离子 | Fe3+ | Zn2+ | Mn2+ | Cu2+ | Cd2+ |
开始沉淀pH | 2.7 | 6.5 | 7.7 | 5.2 | 6.9 |
沉淀完全pH | 3.2 | 8.0 | 9.8 | 6.4 | 9.4 |
请回答下列问题:
(1)提高浸出率可以采用的方法是(写出其中一点即可)______________。
(2)滤液I中有少量的AsO33-,若不除去,则AsO33-与Cd反应会产生一种有毒氢化物气体,该气体的分子式为_________。向滤液I中逐滴滴人酸性KmnO4溶液可与AsO33-发生反应生成FeAsO4,完成该反应的离子方程式:_________
___Fe2++___AsO33-+___MnO4-+ □= Mn2++ FeAsO4↓+ □,判断该滴定终点的现象是_______。
(3)流程中②调节pH时可以选用的试剂为________,滤渣Ⅱ的主要成份为________。
(4)常温下Zn(OH)2的溶度积Ksp=_____________________。
(5)制得的ZnSO4 7H2O需洗涤,洗涤晶体时应选用试剂为________________。
【答案】 适当增大硫酸浓度/升高溶液温度/搅拌/将铜镉渣磨碎成小颗粒等合理答案均可以 AsH3 5Fe2++5AsO33-+3MnO4- +14H+==3Mn2++5FeAsO4+7H2O 滴最后一滴高锰酸钾,溶液变为粉红色且半分钟内不恢复为原色,则反应到终点 ZnO/ZnCO3/Zn(OH)2等合理答案均可 FeAsO4 Fe(OH)3 10-17 乙醇 或饱和硫酸锌溶液
【解析】(1)可以通过适当增大硫酸浓度、升高溶液温度、搅拌、将铜镉渣磨碎成小颗粒等措施提高浸出率;
(2 )AsO33-与Cd反应,Cd被氧化,则AsO33-被还原为一种有毒氢化物气体,此气体的分子式为AsH3 ;向滤液I中逐滴滴人酸性KMnO4溶液可与AsO33-发生反应生成FeAsO4,根据电子守恒、电荷守恒及原子守恒得此反应的离子方程式为5Fe2++5AsO33-+3MnO4- +14H+==3Mn2++5FeAsO4+7H2O,当滴最后一滴高锰酸钾,溶液变为粉红色且半分钟内不恢复为原色,则反应到终点;
(3)流程中②调节pH时,选用的试剂要能与H+反应,同时不引入新的杂质,则可选用的试剂为ZnO、ZnCO3或Zn(OH)2;由图示可知,当溶液pH=4时,溶液中的Fe3+水解完全转化为 Fe(OH)3,则滤渣Ⅱ的主要成份为 Fe(OH)3;
(4)沉淀完全时溶液pH=8,即c(OH-)=1×10-6mol/L,此时溶液中c(Zn2+)浓度为1×10-5mol/L,常温下Zn(OH)2的溶度积Ksp=c(Zn2+)×c2(OH-)=1×10-17;
(5)因ZnSO4·7H2O易溶于水,难溶于酒精,制得的ZnSO4 7H2O晶体可选择酒精或饱和硫酸锌溶液洗涤。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某温度下,向10mL0.1mol/LCaCl2溶液中滴加0.1mol/L的Na2CO3溶液,滴加过程中溶液中-lgc(Ca2+)与Na2CO3溶液体积(V)的关系如图所示,下列有关说法正确的是( )

A. z点对应的分散系很稳定
B. w、x、y三点中,水的电离程度最大的为y点
C. 若用等浓度的Na2SO4溶液代替Na2CO3溶液,则图像在x点后的变化如虚线部分所示
D. Ksp(CaCO3)=5×10-10mol2/L2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.盐溶液都是中性的
B.盐溶液的酸碱性与盐的类型无关
C.碳酸钠溶液显碱性,是因为溶液中c(OH﹣)>c(H+)
D.NaHCO3溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu(NO3)2是重要的化工原料。回答下列工业生产和化学实验中的几个问题。
实验室欲制备0.3 mol Cu(NO3)2晶体,甲、乙两同学分别设计实验方案如下:
![]()
①绿色化学的角度分析,_________同学的方案更合理,此同学可节约2mol/L的稀硝酸_________mL;
②甲方案的离子方程式为___________;
③乙同学实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选择__________方案(填字母序号)。

④B装置如何检查气密性:_________________。
(2)某校化学兴趣小组的同学对硝酸铜的受热分解进行探究。他们设计了如下左图装置加热Cu(NO3)2固体(加热及夹持装置未画出)。加热过程发现:装置①中的固体逐渐变为黑色;装置②中有气泡产生,但在上升的过程中消失;石蕊试液逐渐变为红色,液体几乎不被压至装置③中。请写出Cu(NO3)2受热分解的化学方程式:______________;


(3)NO2、O2和熔融NaNO3可制作燃料电池,其原理见上右图。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下面的信息,推断元素及有关物质,按要求回答物质:
信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息①,X一定不是__________(填序号)
A.氢 B.碳 C.氧 D.硫
信息②:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否有铝元素?___________。
信息③:向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)白色沉淀物的化学式为:________________。
信息④:向上述四种元素单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀。
(4)生成白色沉淀物的离子方程式为 _____________________________。
信息⑤:X与W同主族
(5)①X与浓硫酸加热时反应的化学方程式为______________________。
②工业上通过X与W的化合物制W的单质的化学方程式为:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列括号中的物质是除去杂质所需的药品,其中错误的是( )
A.NaCl溶液中有杂质Na2SO4(氯化钡)
B.FeSO4溶液中有杂质CuSO4(铁粉)
C.生石灰中混有少量石灰石(盐酸)
D.BaCl2溶液中有少量MgCl2(氢氧化钡)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由丙烯经下列反应可得到F和高分子化合物G,它们都是常用的塑料。
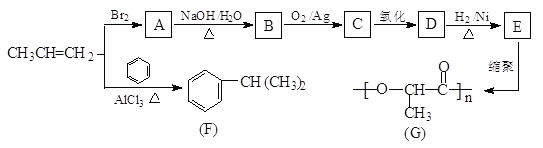
完成下列填空:
(1)F的分子式为_______________,化合物E中所含两个官能团的名称是____、______。
(2)写出反应类型:丙烯直接形成高分子______;A→B____________。
(3)B转化为C的化学方程式为____________。
(4)E的一种同分异构体M具有如下性质:①能发生银镜反应;②1molM与足量的金属钠反应可产生lmolH2,则M的结构简式为____________。
(5)写出由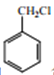 合成
合成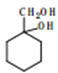 的合成路线________。
的合成路线________。
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“保护环境”是我国的基本国策.下列做法不应该提倡的是( )
A.使用氢能源代替化石燃料,减少CO2排放
B.就地在田间焚烧秸秆,减少运输成本
C.改进汽车尾气净化技术,减少污染物的排放
D.研发可降解高分子材料,减少“白色污染”
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com