
科目:高中化学 来源: 题型:
有关氨气的实验较多,下面对这些实验的分析中,正确的是( )
A.氨气极易溶于水,可以用来做喷泉实验
B.氨气的还原性可以解释氨气与氯化氢的反应实验
C 实验室可用NH4Cl和石灰水制取氨气
D.NH3液化时放出大量的热,因而,不能用氨作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
回答用蒸气密度法测定四氯化碳分子量的有关问题:
(1)下列四图中的正确装置是 .

(2)使用水浴加热的理由是 .
(3)实验中需要记录的数据,除大气压和温度外,还有 .
(4)分别指出下列操作对实验结果的影响(选用"偏大"、"偏小"、"无影响"的字样,填写在短线上):
(a)当CCl4完全气化后,将烧瓶从沸水中取出.如未冷却至室温就擦干、称量,所测定的分子量 .
(b)CCl4未完全气化,就将烧瓶从沸水中取出.冷却至室温,擦干、称量,所测定的分子量 .
(5)这种测定分子量的方法,适用于测定 .
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2O、NaOH、Na2 CO3、NaCl、Na2SO4可按某种标准划为同一类物质,下列分类标准正确的
CO3、NaCl、Na2SO4可按某种标准划为同一类物质,下列分类标准正确的
是 ( )
①钠的化合物 ②能与硝酸反应的物质 ③可溶于水的物质
④电解质 ⑤钠盐 ⑥钠的含氧化合物
A.①③④⑤ B.①②⑤⑥ C.①③④ D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
Li—Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:
2Li++FeS+2e-====Li2S+Fe。有关该电池的下列叙述中正确的是 ( )
A.Li—Al在电池中作为负极材料,该材料中Li的化合价为+1价
B.该电池的电池反应式为2 Li+FeS =Li2S+Fe
C.负极的电极反应式为Al-3e-===Al3+
D.充电时,阴极发生的电极反应式为Li2S+Fe-2e-===2Li++FeS
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性。

(1)D装置中电解饱和食盐水的离子反应方程式为:
(2)为检验氯气的氧化性,则E装置的溶液可以是 。
A.淀粉碘化钾溶液 B.酸性KMnO4溶液
C.FeCl2溶液 D.Na2S溶液
(3)F装置的目的是 。
(4)为测定Cu的相对原子质量,某同学设计了如下的方案:
精确测量硬质玻璃管的质量为a g,放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g,实验完毕后(通过足量的氢气),通过精确测量硬质玻璃管和Cu粉的总质量为c g,进而确定Cu的相对原子质量。
①对B装置中的氧化铜粉末加热前,需要进行的操作为 ;
②A装置中盛放的试剂为 ;
③根据测得结果进行计算,则Cu的相对原子质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。某工厂使用还原沉淀法处理,该法的工艺流程为:
 |
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=12,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72-的浓度不变 b.Cr2O72-和CrO42-的浓度相同
c.2v(Cr2O72-)=v(CrO42-) d.溶液的颜色不变
(3)第②步反应中,还原剂为 ,该还原剂反应后生成 。
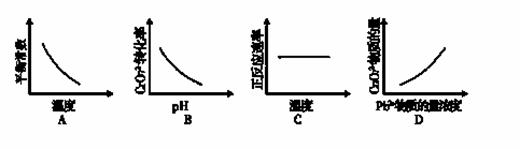
(4)电镀废液中Cr2O72-还可通过下列反应转化:
Cr2O72-(aq)+2Pb2+(aq)+H2O(l) 2 PbCrO4(s)+2H+(aq) ΔH< 0
2 PbCrO4(s)+2H+(aq) ΔH< 0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是
[]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com