
 ,该元素的名称是氧;
,该元素的名称是氧;分析 X元素原子的4p轨道上有3个未成对电子,X元素原子的核外电子排布式为 1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,故X为As元素;Y元素原子的最外层2p轨道上有2个未成对电子,Y的2p轨道上有2个电子或4个电子,所以Y为碳元素或氧元素,X跟Y可形成化合物X2Y3,故Y为氧元素;X、Y和Z三种元素的原子序数之和等于42,则Z的质子数为42-8-33=1,则Z为氢元素,氢原子可以形成负一价离子,符合题意,据此解答.
解答 解:X元素原子的4p轨道上有3个未成对电子,X元素原子的核外电子排布式为 1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,故X为As元素;Y元素原子的最外层2p轨道上有2个未成对电子,Y的2p轨道上有2个电子或4个电子,所以Y为碳元素或氧元素,X跟Y可形成化合物X2Y3,故Y为氧元素;X、Y和Z三种元素的原子序数之和等于42,则Z的质子数为42-8-33=1,则Z为氢元素,氢原子可以形成负一价离子,符合题意.
(1)X元素原子的4p轨道上有3个未成对电子,原子的核外电子排布式为 1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,X为As元素,
故答案为:1s22s22p63s23p63d104s24p3;As;
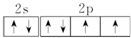
(2)Y为O元素,价层电子的电子排布图(轨道表示式)为 ,
,
故答案为:氧; ;
;
(3)化合物X2Y3为As2O3,XZ3为AsH3,As2O3在稀硫酸溶液中可被金属锌还原为AsH3,产物还有ZnSO4和H2O,反应中Zn元素化合价由0价升高为+2价,As元素化合价由+3价降低为-3价,参加反应的Zn与As2O3的物质的量之比为6×2:2=6:1,反应方程式为:As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O,
故答案为:As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O;
(5)AsH3与NH3、PH3中,键长N-H<P-H<As-H,键长越短,键能越大,化合物稳定,所以稳定性:NH3>PH3>AsH3.
故答案为:NH3>PH3>AsH3;键长N-H<P-H<As-H,键长越短,键能越大,化合物稳定.
点评 本题是对物质结构的考查,涉及核外电子排布规律、氧化还原反应、化学键等,难度中等,正确推断元素Y是关键.


科目:高中化学 来源: 题型:选择题
| A. | F2、Cl2、Br2、I2跟氢气反应的激烈程度逐渐减小 | |
| B. | HF、HCl、HBr、HI的热稳定性依次减小 | |
| C. | F-、Cl-、Br-、I-的还原性依次增强 | |
| D. | HF、HCl、HBr、HI水溶液的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的原子核外电子层数随核电荷数的增多而增多 | |
| B. | 单质的颜色随核电荷数的增多而加深 | |
| C. | 被其它卤素单质从其卤化物中置换出来的可能性随核电荷数的增多而增大 | |
| D. | 它们的氢化物的稳定性随核电荷数的增多而增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CHF=CHCl存在顺反异构 | |
| B. | 结构不同,性质相同,化学式相同的物质互称同分异构体 | |
| C. |  和 和 均是芳香烃, 均是芳香烃,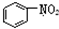 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 | |
| D. |  和 和 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | vA=0.5mol•L-1•s-1 | B. | vB=0.3 mol•L-1•s-1 | ||
| C. | vC=0.8 mol•L-1•s-1 | D. | vD=1.0 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核外有13个电子,其中6个能参与成键 | |
| B. | 核内有6个质子,核外有7个电子 | |
| C. | 质量数是13,原子序数是6,核内有7个质子 | |
| D. | 质量数是13,原子序数是6,核内有7个中子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com